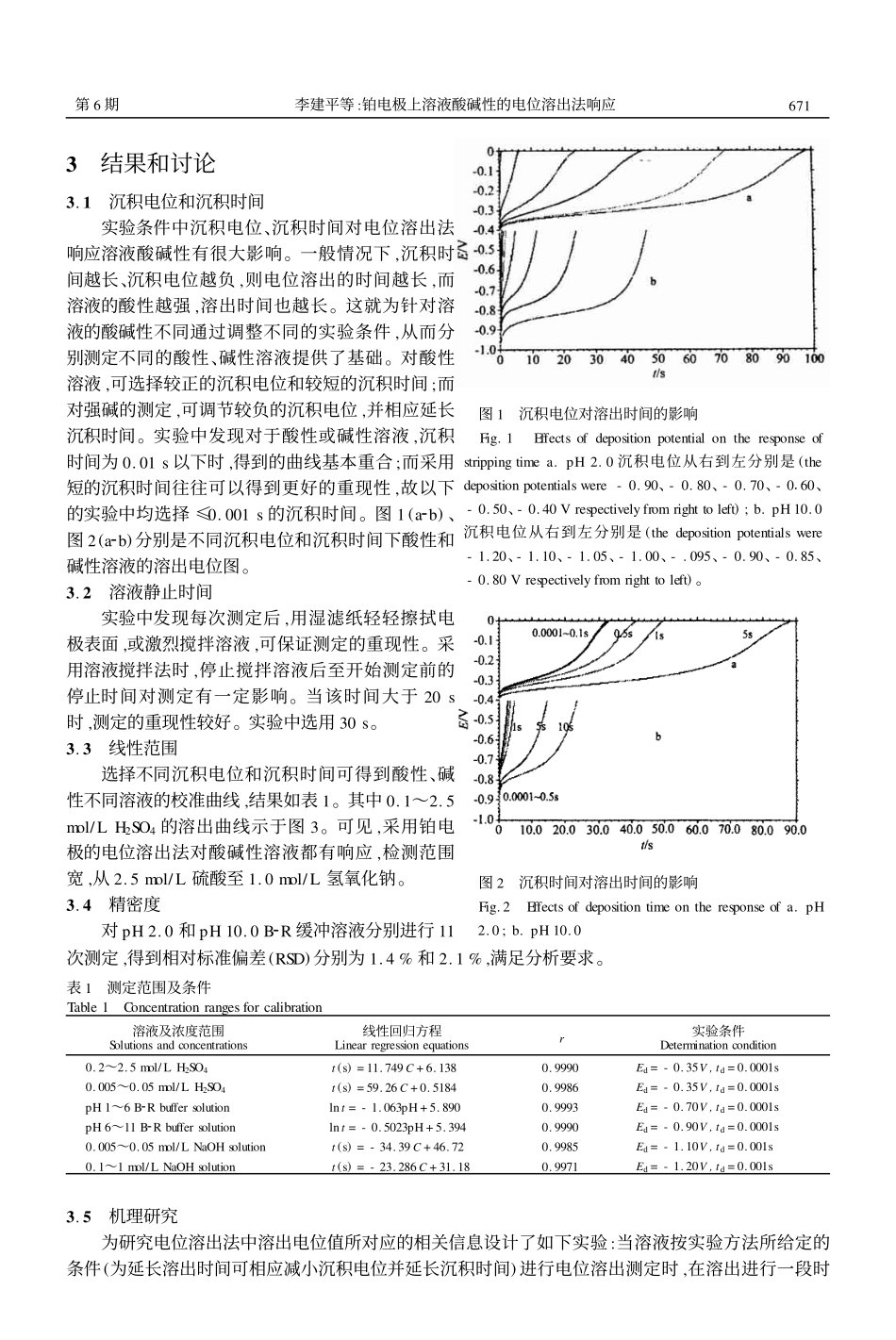
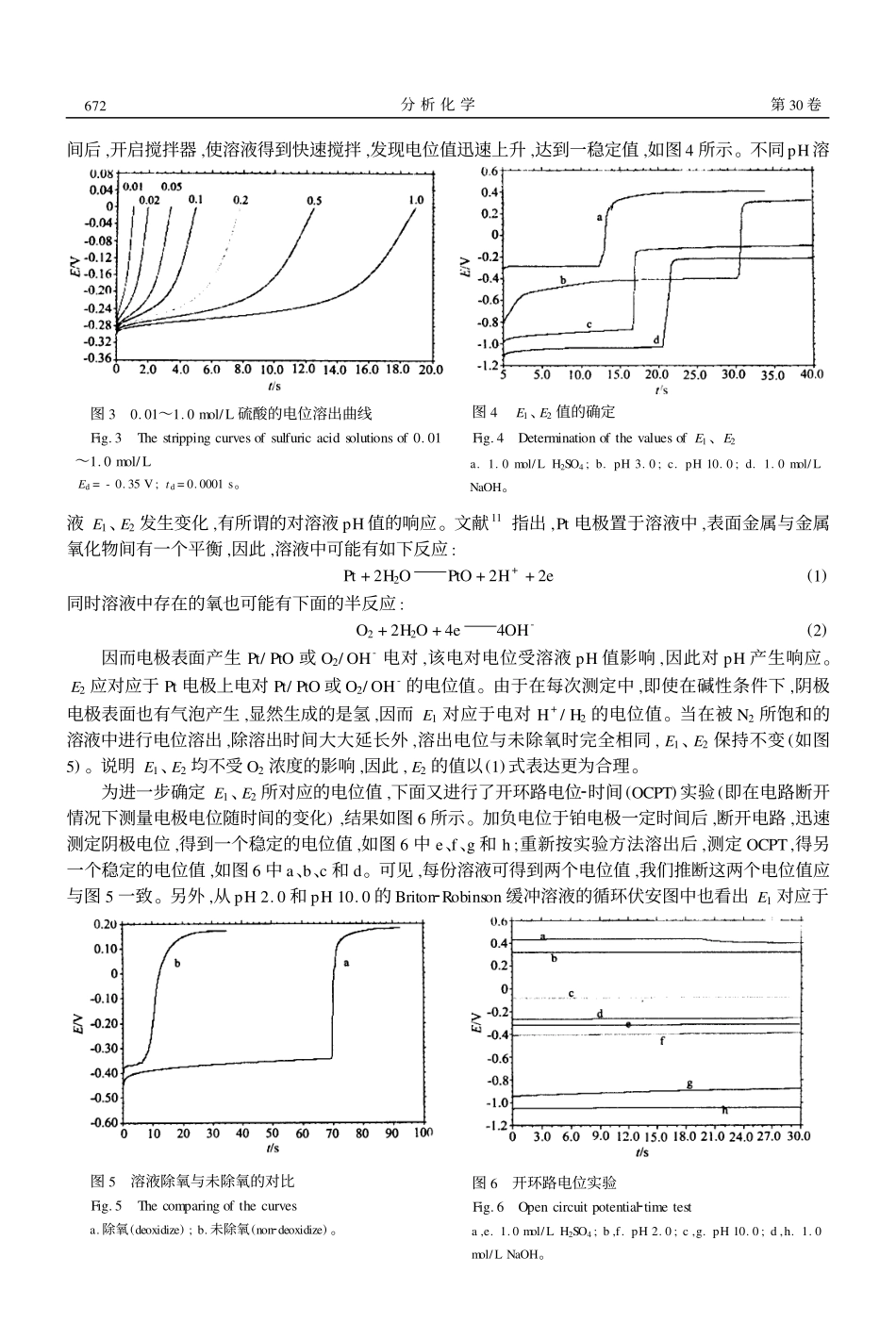
铂电极上溶液酸碱性的电位溶出法响应李建平1,2彭图治311(浙江大学西溪校区化学系,杭州310028)2(桂林工学院应用化学系,桂林541004)摘要提出了一个广谱测定强酸、强碱溶液浓度的方法。用铂电极作工作电极,电位溶出法对溶液酸碱性产生响应。通过调节沉积时间和沉积电位,利用电位溶出法可以检测溶液酸、碱的浓度范围为2.5mol/LH+~1.0mol/LOH-。详细研究了不同测定范围的实验条件,以及溶出过程的响应机理。在不同酸碱性溶液中电沉积产生的氢吸附于电极表面,溶出过程中被溶液中的氧氧化成氢离子,从而产生电位平台。该平台的出现还与随后的电极表面金属/金属氧化物电对电位值有关。关键词强酸强碱测定,电位溶出法,铂电极2001207224收稿;2002201204接受本文系浙江省自然科学基金和浙江省分析测试基金资助项目1引言溶液酸碱性的测定常采用pH玻璃电极法。近来基于光学及电化学法pH传感器的研究也引起人们的重视1~3。但迄今所见的传感器通常测定范围较窄,多数不能用于强酸强碱的测定。而目前测定强酸和强碱的主要方法仍为传统的酸碱滴定法。因此,研制开发能用于强酸、强碱溶液测定的传感器是重要的研究课题之一。文献4,5报道了强酸型光学传感器,测定的酸浓度最高达11mol/LHNO3。文献6报道了用于碱性溶液测定的光学传感器。能用于酸性或碱性溶液测定的电化学传感器及分析法相对较少7~11。用于强酸和弱酸测定的电化学分析法主要集中在基于溶液中H+在微铂电极上还原的伏安分析法7,8,而用于碱性溶液测定的方法主要是根据OH-在电极上氧化时产生氧化峰的伏安法和金属/金属氧化物电极对H+响应的电位法10,11。电位溶出法自D.Jagner提出以来,在无机元素分析尤其是重金属元素痕量分析方面得到了广泛的应用,在有机分析甚至DNA检测等领域的应用也有报道12,13。但电位溶出法对溶液酸碱的响应及用来测定溶液的酸碱性尚未见报道。本文研究了一种广谱测定溶液酸碱性的方法,利用铂电极电位溶出法可实现强酸(如2.5mol/L硫酸)、强碱(1.0mol/L氢氧化钠)溶液浓度和pH值的测定。2实验部分2.1仪器与试剂实验测定均在CHI660电化学系统(美国CHI公司)上进行,采用三电极系统:铂圆盘电极(Φ=1.5mm)为工作电极,Ag/AgCl电极作参比电极,铂丝为对电极。实验中使用的酸为硫酸、盐酸和硝酸。缓冲溶液为Briton2Robinson溶液(0.01mol/LH3PO42H3BO32CH3COOH),缓冲溶液的pH通过加入0.5mol/LHCl或KOH来调节。溶液pH的测定由231型pH电极对照。所用化学试剂均为分析纯,实验用水先经离子交换再蒸馏得到。铂电极表面用Al2O3粉抛光,再于2mol/LHCl220%(V/V)乙醇溶液中超声振荡15min,即可直接使用。2.2实验方法将三电极置于溶液中,每次测定前先搅拌溶液,然后停止搅拌使溶液静止30s,随即进行电位溶出,测量溶出时间。电位溶出法的参数(沉积电位、沉积时间和终止电位),可随溶液的酸碱性不同而进行相应的选择。第30卷2002年6月分析化学(FENXIHUAXUE)研究报告ChineseJournalofAnalyticalChemistry第6期670~674图1沉积电位对溶出时间的影响Fig.1Effectsofdepositionpotentialontheresponseofstrippingtimea.pH2.0沉积电位从右到左分别是(thedepositionpotentialswere-0.90、-0.80、-0.70、-0160、-0.50、-0.40Vrespectivelyfromrighttoleft);b.pH10.0沉积电位从右到左分别是(thedepositionpotentialswere-1.20、-1.10、-1.05、-1.00、-.095、-0.90、-0.85、-0.80Vrespectivelyfromrighttoleft)。3结果和讨论3.1沉积电位和沉积时间实验条件中沉积电位、沉积时间对电位溶出法响应溶液酸碱性有很大影响。一般情况下,沉积时间越长、沉积电位越负,则电位溶出的时间越长,而溶液的酸性越强,溶出时间也越长。这就为针对溶液的酸碱性不同通过调整不同的实验条件,从而分别测定不同的酸性、碱性溶液提供了基础。对酸性溶液,可选择较正的沉积电位和较短的沉积时间;而对强碱的测定,可调节较负的沉积电位,并相应延长沉积时间。实验中发现对于酸性或碱性溶液,沉积时间为0.01s以下时,得到的曲线基本重合;而采用短的沉积时间往往可以得到更好的重现性,故以下的实验中均选择≤0.001s的沉积时间。图1(a2b)、图2(a2b)分别是不同沉积电位和沉积时间下酸性和碱性溶液的...