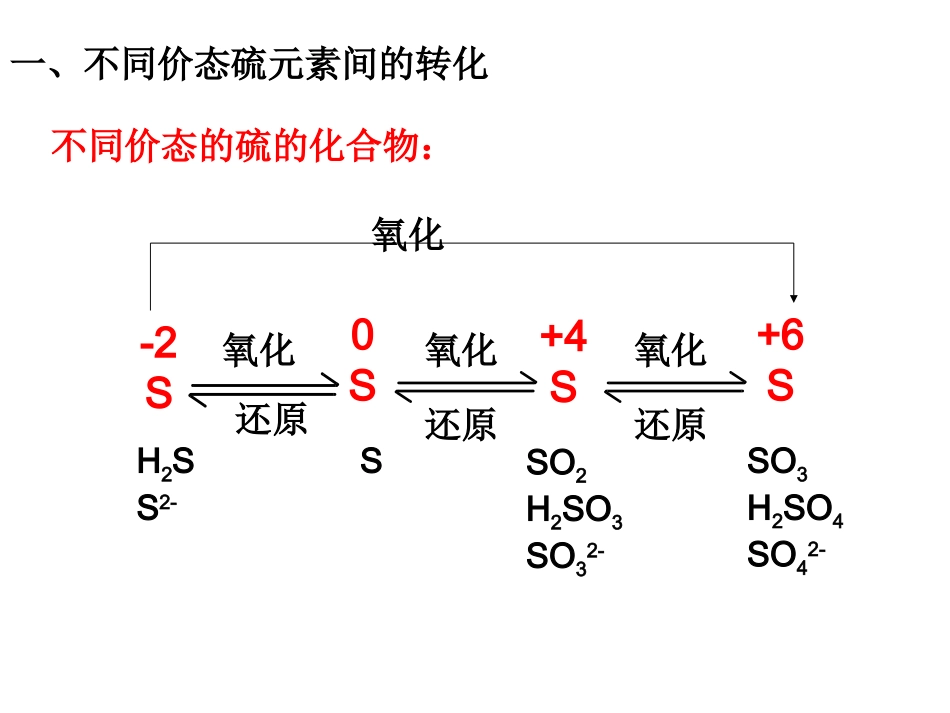
2010年高考化学第一轮复习含硫化合物的性质和应用考纲要求:1、了解硫元素单质及其化合物的主要性质和重要应用2、了解常见硫元素单质及其化合物之间转化的条件和方法3、认识硫元素单质及其化合物在生产中的应用和对生态环境的影响4、了解SO32-、SO42-等常见离子的检验方法。不同价态的硫的化合物:-2S0S+4S+6SH2SS2-SSO2H2SO3SO32-SO3H2SO4SO42-氧化氧化氧化还原还原还原氧化一、不同价态硫元素间的转化Na2SO4BaSO4H2SFeSHgSSO2SO3H2SO4H2SO3Na2SO3不同价态硫元素之间的转化S+Hg+H2O+Ba2++NaOH+O2+H2OH2SO4(浓)++Cl2+H2SO4+O2+O2+O2+Fe+Na2O二、典型含硫物质的性质(一)、硫单质1、物理性质:淡黄色晶体,不溶于水,微溶于酒精,易溶于CS2,熔、沸点较低。根据硫的物理性质,可用何种方法除去沾在试管上的硫?2、化学性质:(1)、和金属的反应Na2S为白色固体,溶于水。2Na+S=Na2S研磨FeS为黑色固体,不溶于水,溶于强酸。Fe+S=FeS2Cu+S=Cu2SCu2S为黑色固体,不溶于水,不溶于稀酸。硫和变价金属反应时,一般生成低价金属硫化物。(2)、和非金属的反应H2+S=H2SS+O2=SO2点燃S+2H2SO4(浓)3SO2+2H2O△△S+6HNO3(浓)H2SO4+6NO2+2H2O(3)、与某些化合物反应(4)、与碱反应3S+6KOH=2K2S+K2SO3+3H2O△1.下列说法不正确的是()A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫与氧属于同一主族D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫D(二)、二氧化硫1、物理性质:SO2是无色、有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水(1:40)。2、化学性质:SO2是一种酸性氧化物,由于SO2中硫元素为+4价,属于中间价态,所以SO2既有还原性又有氧化性(1)、酸性氧化物的通性亚硫酸(二元弱酸)SO2+H2OH2SO3SO2+2NaOHNa2SO3+H2OSO2+CaOCaSO3△(2)、具有强还原性与常见的氧化剂反应。如:O2、Cl2、Br2、I2、Fe3+、KMnO4、HClO、HNO3、NO2、Na2O2等SO2+Br2+2H2O=H2SO4+2HBr2SO2+O22SO3(3)、SO2的氧化性SO2+2H2S=3S↓+2H2O(4)、具有漂白性——能使品红褪色SO2跟某些有色物质化合生成无色物质,但无色物质不稳定,见光、遇热或长久放置又容易分解恢复至原来的颜色。例如SO2能使品红溶液褪色,但受热后恢复红色。【例1】下图是实验室制取SO2并验证SO2的某些性质的装置图。试回答:(1)在⑥中发生的化学反应方程式为________________。(2)①中的实验现象为石蕊试液________,此实验证明SO2是_______气体。(3)②中的品红溶液__________,证明SO2有________性。(4)③中的实验现象是_________,证明SO2有_________性。(5)④中的实验现象是_________,证明SO2有_________性。(6)⑤的作用是________,反应的化学方程式为_________。(三)、硫酸1、硫酸的物理性质纯硫酸是一种无色粘稠的液体,常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为1.84g·cm-3,其物质的量浓度为18.4mol·L-1。硫酸是一种高沸点、难挥发的强酸,易溶于水,能以任意比与水混溶。2、稀H2SO4硫酸是强电解质,在水溶液中发生电离:H2SO4=2H++SO42-,溶液呈强酸性。与指示剂、碱、碱性氧化物、活泼金属、盐等物质发生反应。特别提醒浓硫酸溶解时放出大量的热,稀释时应将浓硫酸沿器壁慢慢加入水中,边加边搅拌。(1)吸水性①中学化学中常用浓H2SO4干燥的气体有:H2、O2、CO2、SO2、Cl2、HCl等。②不能用浓硫酸干燥的气体有:碱性气体,如NH3;还原性气体,如H2S等。3、浓H2SO4的特性(2)脱水性脱水性:指浓H2SO4将有机物里的氢、氧元素按原子个数21∶的比例脱去水的性质。C12H22O1112C+11H2O浓硫酸(1)与金属反应Cu+2H2SO4(浓)=CuSO4+SO2+2H2O(3)、强氧化性强氧化性C+2H2SO4(浓)=CO2+2SO2+2H2O(2)与非金属及一些还原性物质反应常温下,与Al、Fe发生钝化((44)、难挥发性)、难挥发性NaCl+H2SO4(浓)=NaHSO4+HCl3、下列各叙述中说明硫酸具有什么性质,请填空:(1)敞口放置于空气中的浓硫酸会增重________;(2)用铁、铝金属容器可以运输浓H2SO4______________;(3)浓H2SO4与Cu反应制取SO2_______________;(4)新制的Cl2通过浓H2S...