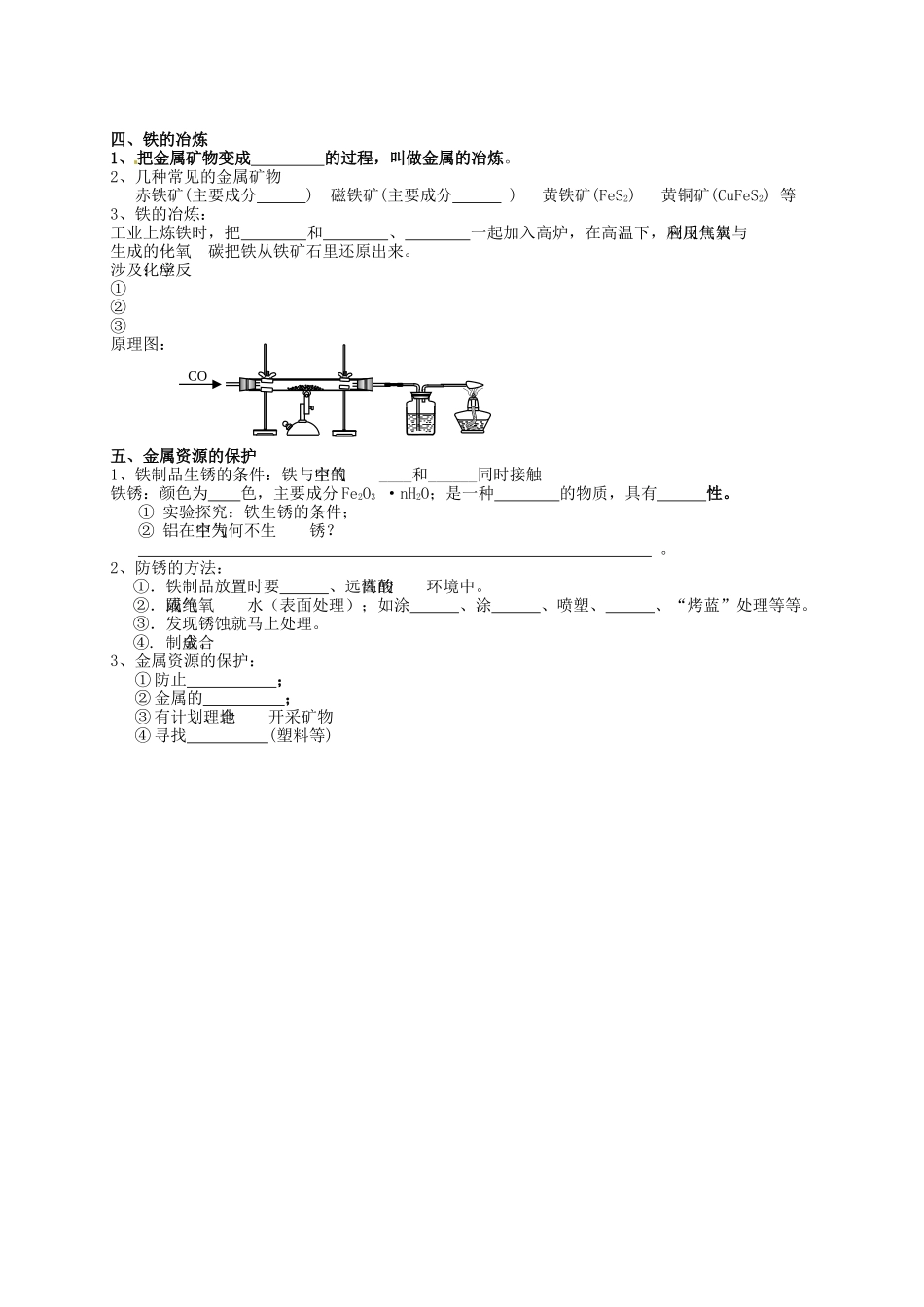
九年级化学下册第八单元金属和金属材料一、金属的物理性质1、常温下是固体(除Hg外);2、有金属光泽;3、大多是热和电的良导体;4、有延展性;5、熔点较高。补充:①铁、铝、银→色;铜→色;金→色。②常温下(俗称)为液态。用途:主要决定于金属的,还要考虑、、是否美观、使用是否便利、废料是否便于回收、等诸多因素。二、金属的化学性质化学性质实例说明①与氧气反应Mg+O2==Al+O2==Fe+O2Cu+O2大多数金属都能与氧气反应,但难易和剧烈程度不同。Mg、Al在常温下能与O2反应,Fe、Cu常温下难与O2反应,Au在高温时也不与O2反应②与盐酸和稀硫酸反应Mg+H2SO4==Zn+H2SO4==Fe+H2SO4==Fe+HCl==Zn+HCl==在金属活动性顺序里,位于H前面的金属置换出盐酸、稀硫酸中的氢,活动性越强,反应越。而位于后面的则。③与某些金属的化合物溶液反应Al+CuSO4==Fe+CuSO4==Cu+AgNO3==Fe+ZnSO4==在金属活动性顺序里,位于的金属能把位于的金属从它们的化合物溶液中置换出来金属活动性顺序:________、________(__)、________。【题型应用】(1)、探究金属活动性顺序方法:1、分别与相同的酸反应(略);2、选择中间的金属,两端的盐溶液;3、选择中间的盐溶液,两端的金属。(2)、有关金属与酸反应的计算1、制取相同质量的氢气(酸过量),需要的金属谁多谁少?2、制取相同质量的氢气(金属过量),需要的酸相同。不同金属在物理性质上差别很大地壳中含量最高的金属元素是____,人体中含量最高的金属元素是____,目前世界年产量最高的金属是____,导电、导热性最好的金属是_____,熔点最低的金属_____,熔点最高的金属_____,硬度最高的金属____。3、相同质量的金属(酸足量),制取的氢气谁多谁少?4、识图(t-m图):①比较金属的活动性;②产生相同氢气时,比较参加反应的金属质量的多少③不同质量的金属,产生相同氢气时,比较金属相对原子质量的大小;④相同质量的金属,产生不同氢气时,比较金属相对原子质量的大小;⑤金属过量时,比较酸的多少。三、合金1、合金是一种跟其他______(或_______)熔合形成的具有金属特性的________。2、合金的特性:①合金的硬度组成它们的金属②合金的熔点组成它们的金属③合金的抗腐蚀能力一般各组分金属3、常见合金【讨论】如何区分“黄铜”与“黄金”?①②③④tmBAtmBA铁合金生铁成分:含碳2%~4.3%、及S、Mn等。分类:白口铁、灰口铁、球墨铸铁原料:铁矿石、焦碳、石灰石。冶炼:原理:Fe2O3+3CO____+____主要设备:高炉钢成分:含碳0.03%~2%分类:碳素钢、合金钢(不锈钢、锰钢等)特性:较硬、有良好的延性、展性、机械性能好原料:生铁、废钢。冶炼:原理:高温下使生铁中的碳等杂质转变成气体或炉渣而除去(富氧炼钢、百炼成钢)主要设备:炼钢炉①黄铜:铜、锌白铜:铜、镍焊锡:锡、铅武德合金:保险丝硬铝:火箭、飞机材料钛合金:熔点高、密度小、抗腐性能好,应用前景好②其它合金图1:已知A、B的相对原子质量大小,比较所用金属的质量图2:相同质量的金属,比较A、B的相对原子质量大小四、铁的冶炼1、把金属矿物变成的过程,叫做金属的冶炼。2、几种常见的金属矿物赤铁矿(主要成分)磁铁矿(主要成分)黄铁矿(FeS2)黄铜矿(CuFeS2)等3、铁的冶炼:工业上炼铁时,把和、一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。涉及化学反应:①②③原理图:五、金属资源的保护1、铁制品生锈的条件:铁与空气中的____和______同时接触铁锈:颜色为色,主要成分Fe2O3·nH2O;是一种的物质,具有性。①实验探究:铁生锈的条件;②铝在空气中为何不生锈?。2、防锈的方法:①.铁制品放置时要、远离酸性的环境中。②.隔绝氧气或水(表面处理);如涂、涂、喷塑、、“烤蓝”处理等等。③.发现锈蚀就马上处理。④.制成合金。3、金属资源的保护:①防止;②金属的;③有计划、合理地开采矿物④寻找(塑料等)CO