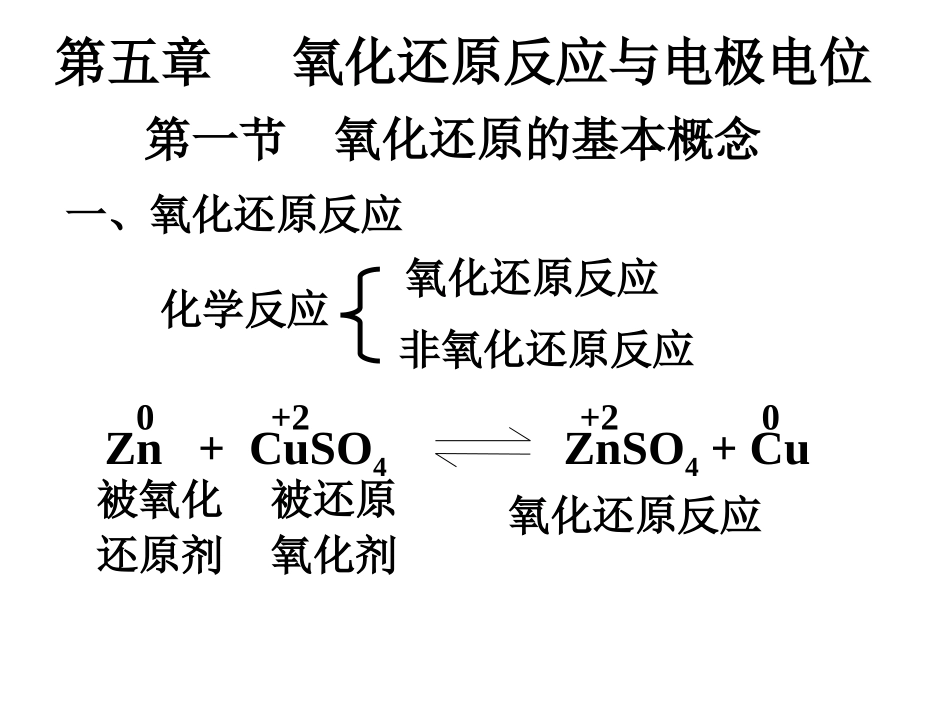
第五章氧化还原反应与电极电位Zn+CuSO4ZnSO4+Cu氧化还原反应被氧化还原剂被还原氧化剂+20+20第一节氧化还原的基本概念一、氧化还原反应化学反应氧化还原反应非氧化还原反应二、氧化还原半反应(一)半反应2Fe3++Sn2+=2Fe2++Sn4+还原反应Fe3++e-=Fe2+氧化反应Sn2+-2e-=Sn4+半反应通式:Ox+ne-=Red两个半反应之和就是一个氧化还原反应。OxidantReducer(二)电对1、定义:电对氧化型还原型较高价态较低价态2、表示:氧化型(Ox)/还原型(Red)Fe3+/Fe2+Sn4+/Sn2+3、Ox与Red之间的共轭关系1)转化Ox+ne-=Red2)能力强弱MnO4-/Mn2+Zn2+/Zn氧化能力MnO4-Zn2+>还原能力Mn2+Zn<在氧化还原反应中,氧化剂和它的还原产物及还原剂和它的氧化产物2Fe3++Sn2+=2Fe2++Sn4+如Fe3+,Fe2+;Sn4+,Sn2+第二节原电池与电极电位一、原电池(一)原电池的概念Zn+CuSO4ZnSO4+Cu氧化还原反应失去电子还原剂得到电子氧化剂化学能Zn+CuSO4直接接触热能电能原电池CuSO4液Zn原电池:利用氧化还原反应将化学能转变成电能的装置。(二)电极反应和电池反应负极Zn-2e-Zn2+正极Cu2++2e-Cu电池反应Zn+Cu2+=Zn2++Cu1、电极反应氧化反应还原反应电极反应或半电池反应电极或半电池2、电池反应Zn-2e-Zn2+Cu2++2e-Cu电极反应电极反应通式:Ox+ne-=Red(三)盐桥的组成和作用2、作用:饱和KCl(NH4NO3)溶液和琼脂制成的凝胶1、组成:中和电荷,维持电路通畅(四)电极组成式和电池组成式(符号表示)书写电极组成式规定:1、电极的符号表示---电极组成式1)写出电极的化学组成,组成电极的溶液要注明浓度,若为气体要注明压力(P)。Zn2+(c)Zn2)用“|”表示极板(金属)与溶液之间的界面。3)用逗号“,”区分同一相中的不同组分,以及电极中的其它相界面。4)当气体或液体不能直接和普通导线相连时,应以不活泼的惰性导体(如铂)作电极板起导电作用。,Pt纯气体、液体和固体,紧靠电极板Pt如Fe3+/Fe2+,Cl2/Cl-,Fe3+(c1)Fe2+(c2)Cl2(p)Cl-(c),2、原电池的符号表示(-)ZnZn2+(c1)Cu2+(c2)Cu(+)负极(-)在左,正极(+)在右,盐桥用“||”(原电池组成式)例1:写出下列自发氧还反应组成的原电池符号(原电池组成式)Cu+2Ag+(a=1.0)=Cu2+(a2=0.10)+2Ag。负极,氧化反应:Cu→Cu2++2e-电极组成式:Cu|Cu2+(0.10molL-1)正极,还原反应:Ag++e→AgAg|Ag+(1.0molL-1)电极组成式:原电池组成式:(-)Cu|Cu2+(0.10)||Ag+(1.0)|Ag(+)2、1/2H2(P)+Fe3+(c1)H+(c2)+Fe2+(c3)负极1/2H2H++e-正极Fe3++eFe2+(-)PtH+(c2)Fe3+(c1),(+),H2(P)Fe2+(c3)Pt3、2Fe2+(0.05)+MnO2+4H+(0.1)2Fe3+(0.5)+Mn2+(0.01)+2H2O负极Fe2+Fe3++e-正极MnO2Mn2++4H++2H2O+2e-(-)PtFe3+(0.5)Fe2+(0.05),Mn2+(0.01)H+(0.1),MnO2Pt,(+)写出氧化还原反应Sn2++2Fe3+=Sn4++2Fe2+的电池组成式。[解](-)ptSn2+(c1),Sn4+(c2)||Fe2+(c3),Fe3+(c4)pt(+)[例]将下列氧化还原反应拆成两个半电池反应,并写出电极组成式和电池组成式。2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2[解]负极H2O2-2e-O2+2H+正极MnO4-+8H++5e-Mn2++4H2OMnO4-(c1),Mn2+(c2),H+(c3)PtH+(c4),H2O2(c5)O2(p),Pt(-)Pt,O2(p)H2O2(c5),H+(c4)||MnO4-(c1),Mn2+(c2),H+(c3)Pt(+)二、电极电位(一)电极电位的产生M(s)Mn+(aq)+ne-溶解沉积2、影响电极电位的因素用表示1)物质的本性3)浓度2)温度3、电池电动势E=+--1、产生原因(二)电极电位的测定1、标准氢电极1)组成:H+/H22)电极反应2H+(aq)+2e-=H2(g)电极组成式:H+(1molL-1)H2(100kPa),pt3)(H+/H2)=0(V)2、标准电极电位c=1molL-1,p=100kPa指定温度,298.15K298.15K1)标准态(电极):2)标准电极电位:电极处于标准态时的电极电位以表示3)标准电极电位的测定步骤a)组成原电池:标准氢电极||标准待测电极b)测定原电池EΘc)根据EΘ=Θ+-Θ-,已知Θ(H+/H2),即可求出另一Θ。测(Cu2+/Cu)pt,H2(100kPa)H+(1molL-1)Cu2+(1molL-1)Cu测得298.15KE=0.3419VE=+--=0.3419(Cu2+/Cu)=0.3419(V)(-)(+)测(Zn2+/Zn)298.15KE=0.7618V...