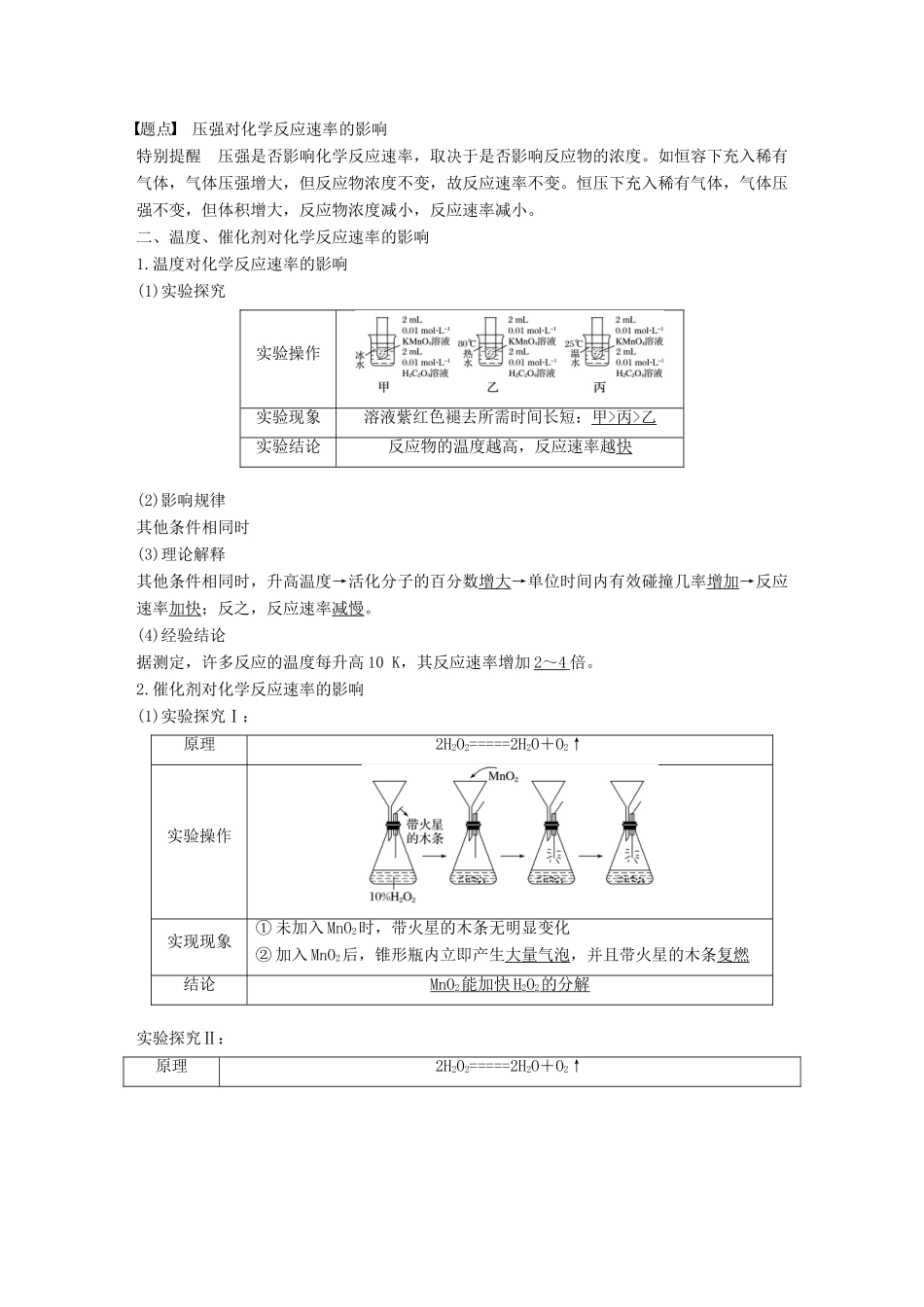
第2课时影响化学反应速率的因素[学习目标定位]1.了解活化能的含义,会用活化能理论解释化学反应速率的影响因素。2.掌握外界条件(浓度、压强、温度、催化剂)对化学反应速率的影响规律及实质,并会用相应规律解决有关问题。一、有效碰撞理论浓度、压强对化学反应速率的影响1.有效碰撞理论(1)有效碰撞(2)活化能和活化分子①活化分子:能够发生有效碰撞的分子。②活化能:活化分子所多出的那部分能量(或普通分子转化成活化分子所需要的能量)。(3)反应物、生成物的能量与活化能的关系图特别提醒反应的活化能越低,活化分子百分数越大,反应速率越快。2.浓度对化学反应速率的影响(1)按表中实验步骤完成实验,观察实验现象,填写下表:实验操作实验现象气球膨胀速率:甲>乙;相同时间内膨胀的体积:甲>乙实验结论c(HCl)增大,生成CO2的速率加快;反之,减慢(2)影响规律其他条件相同时(3)理论解释其他条件不变时,增大反应物浓度→单位体积内活化分子数增多→有效碰撞次数增多→化学反应速率增大。反之,减小反应物浓度,化学反应速率减小。3.压强对化学反应速率的影响(1)影响规律对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。如图所示:由图可知:其他条件不变时,增大压强,气体体积缩小,浓度增大,化学反应速率加快。(2)理论解释增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞几率增加→反应速率加快;反之,反应速率减慢。(1)对于固体或纯液体,其浓度可视为常数,因而其物质的量改变时不影响化学反应速率。(2)固体物质的反应速率与接触面积有关,颗粒越细,表面积越大,反应速率就越快,块状固体可以通过研细来增大表面积,从而加快化学反应速率。(3)当其他条件不变,若压强变化能引起参与反应物质的浓度发生变化时,化学反应速率才能发生变化。例1把下列4种X溶液,分别加入到4个盛有10mL2mol·L-1盐酸的烧杯中,并加水稀释到50mL,此时X与盐酸缓缓地进行反应,其中反应速率最大的是()A.20mL,3mol·L-1B.20mL,2mol·L-1C.10mL,4mol·L-1D.10mL,2mol·L-1答案A解析此题主要考查浓度对化学反应速率的影响,X溶液的浓度大小决定了反应速率的快慢。那么是否是C中4mol·L-1的X与盐酸反应速率最快呢?此题很容易错选C选项,实际上应考虑加水稀释后溶液中X的浓度,同一体积的溶液中X的物质的量越大,浓度就越大,A中X的物质的量最大,故速率最大。考点影响化学反应速率的因素题点浓度对化学反应速率的影响例2一定温度下,反应N2(g)+O2(g)2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是()A.缩小体积使压强增大B.恒容,充入N2C.恒容,充入HeD.恒压,充入He答案C解析C项,恒容,充入He,由于N2、O2、NO的浓度均不变,所以化学反应速率不改变。考点影响化学反应速率的因素题点压强对化学反应速率的影响特别提醒压强是否影响化学反应速率,取决于是否影响反应物的浓度。如恒容下充入稀有气体,气体压强增大,但反应物浓度不变,故反应速率不变。恒压下充入稀有气体,气体压强不变,但体积增大,反应物浓度减小,反应速率减小。二、温度、催化剂对化学反应速率的影响1.温度对化学反应速率的影响(1)实验探究实验操作实验现象溶液紫红色褪去所需时间长短:甲>丙>乙实验结论反应物的温度越高,反应速率越快(2)影响规律其他条件相同时(3)理论解释其他条件相同时,升高温度→活化分子的百分数增大→单位时间内有效碰撞几率增加→反应速率加快;反之,反应速率减慢。(4)经验结论据测定,许多反应的温度每升高10K,其反应速率增加2~4倍。2.催化剂对化学反应速率的影响(1)实验探究Ⅰ:原理2H2O2=====2H2O+O2↑实验操作实现现象①未加入MnO2时,带火星的木条无明显变化②加入MnO2后,锥形瓶内立即产生大量气泡,并且带火星的木条复燃结论MnO2能加快H2O2的分解实验探究Ⅱ:原理2H2O2=====2H2O+O2↑实验操作产生气泡快慢较快较慢结论对比①与②可知:Cu2+、Fe3+对H2O2分解都有催化作用,但Fe3+催化作用较强(2)影响规律:当其他条件不变时,使用催化剂,化学反应速率增大。(3)理论解释:使用催化剂→改变了反应的...