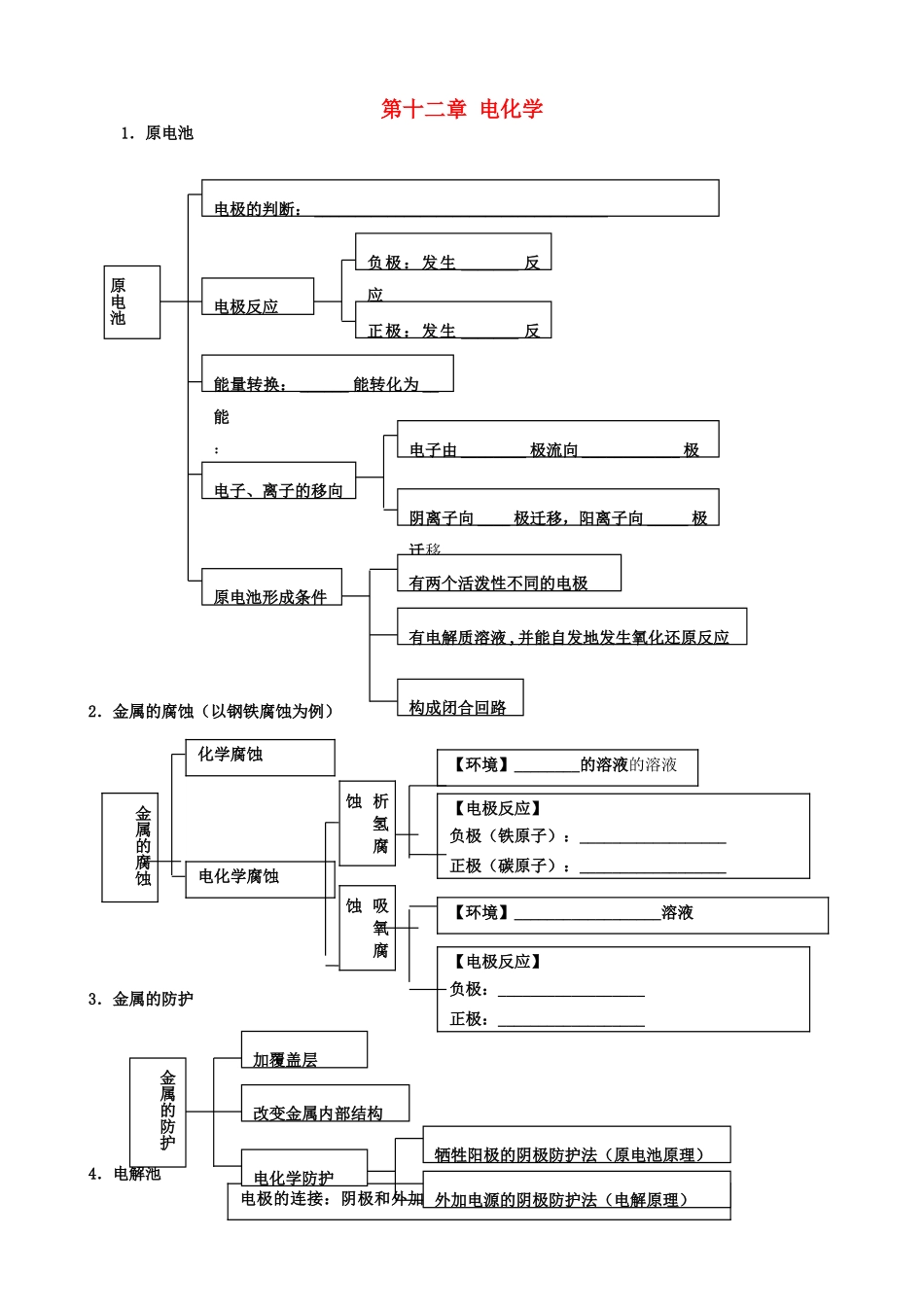
第十二章电化学1.原电池2.金属的腐蚀(以钢铁腐蚀为例)3.金属的防护4.电解池原电池电极的判断:____________________________________电极反应负极:发生_______反应正极:发生_______反应能量转换:______能转化为__能:电子、离子的移向电子由________极流向____________极阴离子向____极迁移,阳离子向_____极迁移原电池形成条件有电解质溶液,并能自发地发生氧化还原反应有两个活泼性不同的电极构成闭合回路金属的腐蚀化学腐蚀电化学腐蚀【电极反应】负极(铁原子):__________________正极(碳原子):__________________【环境】________的溶液的溶液析氢腐蚀吸氧腐蚀【环境】__________________溶液【电极反应】负极:__________________正极:__________________电极的连接:阴极和外加电源___极相连;阳极和外加电源__极相连加覆盖层牺牲阳极的阴极防护法(原电池原理)外加电源的阴极防护法(电解原理)金属的防护电化学防护改变金属内部结构【知识精要】一、原电池原理及应用原电池是一种由化学能转变成电能的装置。其本质是通过自发进行的氧化还原反应,使反应中电子转移而产生电流,反应中的氧化反应和还原反应分别在两个电极上发生,这便形成了带电粒子按一定方向流动的闭合回路高考资源网1.原电池的判定先分析有无外接电源,有外接电源者为电解池,无外接电源者可能为原电池;再依据原电池的形成条件分析判定,主要思路是“三看”:一看电极,两极为导体且活泼性不同;二看溶液,两极插入电解质溶液中;三看回路:形成闭合回路或两极接触。2.原电池正极和负极的确定电解池电极反应阳极:发生________反应阴极:发生________反应能量转换:电能转化为化学能电子、离子的移向电子________________________________阴离子向______,阳离子_____________两极放电情况电极材料:活泼电极做阳极,电极自身发生氧化反应阳离子的放电顺序:阴离子的放电顺序:3.原电池原理的应用(1)利用原电池原理可以制造出各种实用电池,即化学电源,如锌锰干电池、铅蓄电池、锂电池、新型燃料电池等。(2)原电池原理可用于解决一些实际问题,如加快某些化学反应时的速率(稀硫酸与锌反应时,常滴入几滴硫酸铜溶液);分析金属电化学腐蚀的快慢和防护方法等。[重点提醒]两极反应的分析与书写:资源网两(3)常见电极反应式(a)氢、氧燃料电池:强碱做电解质溶液:负极:正极:强酸做电解质溶液:负极:正极:(b)甲烷燃烧电池(电池负极甲烷燃烧失去电子,在碱性条件下生成的CO2与OH-反应生成CO32-和H2O,而正极是O2得到电子而成为OH-。)负极:____________________________________正极:__________________(e)铅蓄电池负极:____________________________________正极:____________________________________二、电解原理及应用电解池是将电能转化为化学能的装置,在电解池中,阳极发生氧化反应、阴极发生还原反应,其放电顺序一般为:阳极:活泼性电极>>>>>>含氧酸根离子阴极:与金属活动顺序表中金属阳离子的氧化顺序一致1.(惰性电极)电解电解质溶液的类型,请举例并完成两极反应与总反应2.电解原理的应用(1)电解精炼铜:____________作阳极,______________作阴极,CuSO4溶液作电解质溶液。电解时,发生如下反应:阳极,__________________,阴极,__________________。阳极泥中存在金、银等不活泼的贵重金属,阴极得到纯铜。(2)电镀铜:____________作阳极,_______________作阴极,硫酸铜(或其他可溶性铜盐)溶液作电解质溶液,从理论上讲电镀时电解质溶液组成、浓度和质量不变化。电极反应:阳极__________________,阴极__________________高考资源网(3)氯碱工业:阳极__________________,阴极__________________总反应____________________________________(反应条件:直流电)(4)冶炼金属:电解熔融电解质,可炼得活泼金属。如:K、Na、Ca、Mg、Al等金属可通过电解其熔融的氯化物或氧化物制得。电源的负极是最强的“还原剂”,可“强迫”活泼金属的阳离子得电子。电解冶炼钠:阳极反应:____________________________________阴极反应:______________...