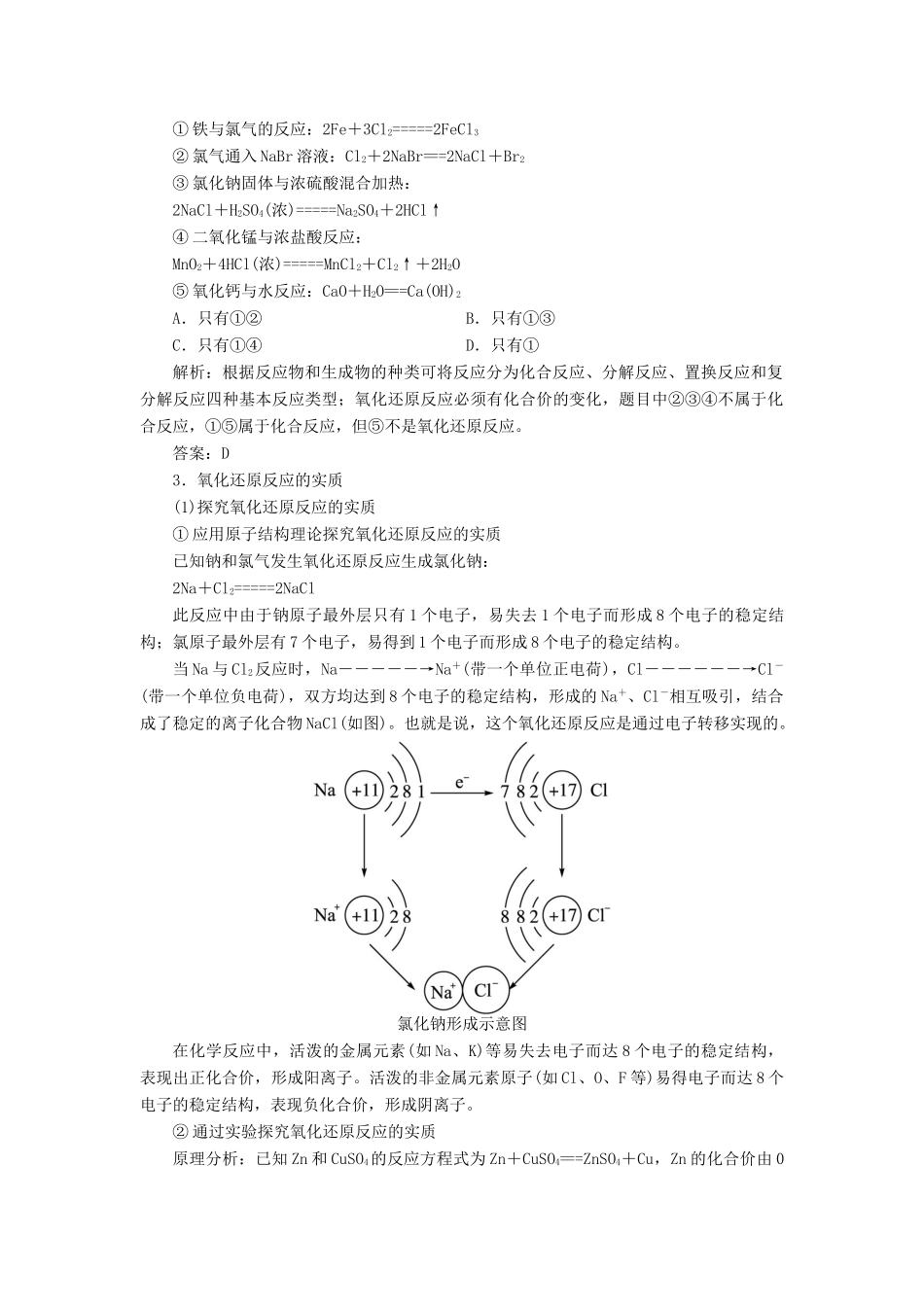
第3节氧化剂和还原剂1.氧化还原反应(1)化学反应与元素化合价的变化在化学学习和日常生活中,我们已经认识了许多化学反应,如铜与氧气的反应、氧化铜与氢气的反应、铁与CuSO4溶液的反应、碳酸钙高温下的分解反应、NaCl溶液与AgNO3溶液的反应等。下面写出它们的化学方程式,分析参加反应的各种物质所含元素的化合价在反应前后是否发生了变化?如何变化?①2Cu+O2=====2CuO②Fe+CuSO4===FeSO4+Cu③CuO+H2=====Cu+H2O④CaCO3=====CaO+CO2↑⑤NaCl+AgNO3===NaNO3+AgCl↓分析:①2Cu+O2=====2CuO,铜元素由0价升为+2价,氧元素由0价降为-2价。②Fe+CuSO4===FeSO4+Cu,铁元素由0价升为+2价,铜元素由+2价降为0价。③CuO+H2=====Cu+H2O,铜元素由+2价降为0价,氢元素由0价升为+1价。④CaCO3=====CaO+CO2↑,反应前后各元素的化合价均没有发生变化。⑤NaCl+AgNO3===NaNO3+AgCl↓,反应前后各元素的化合价均没有发生变化。由以上几个反应可知:从反应过程中元素化合价有无变化的角度,可以将化学反应分为两类:一类是有元素化合价变化的反应;一类是没有元素化合价变化的反应。在有元素化合价变化的化学反应中,既有元素的化合价升高,又有元素的化合价降低。(2)氧化还原反应①氧化还原反应的定义在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。在反应过程中没有元素化合价变化的化学反应叫做非氧化还原反应。谈重点判断氧化还原反应的依据判断一个反应是氧化还原反应还是非氧化还原反应,关键是分析反应过程中有无化合价的变化。②氧化反应和还原反应在氧化还原反应中,反应物所含某种或某些元素化合价升高的反应称为氧化反应;反应物所含某种或某些元素化合价降低的反应称为还原反应。作为一个反应,有化合价升高必然有化合价降低,因而氧化反应和还原反应是氧化还原反应中两个对立统一的方面,在同一个反应中,氧化反应和还原反应必然同时发生。【例1】下列反应不属于氧化还原反应的是()A.3CuS+8HNO3(稀)=====3Cu(NO3)2+2NO↑+3S↓+4H2OB.6KOH+3Cl2=====5KCl+KClO3+3H2OC.Ba(OH)2+Na2SO4===BaSO4↓+2NaOHD.Fe2O3+2Al=====Al2O3+2Fe解析:判断一个反应是不是氧化还原反应,关键是分析反应前后元素的化合价有没有变化。化学方程式中,不管有多少种元素,只要能找出其中某一种元素化合价有变化,这个反应就是氧化还原反应;反之,所有元素化合价都没有发生变化的反应,就是非氧化还原反应。A中S元素由-2价变成了0价,同时也有部分N元素由+5价变成了+2价;B中Cl元素化合价反应前是0价,反应后部分变为-1价,部分变成+5价;D中Al元素反应前为0价,反应后变为+3价,同时Fe元素也由+3价变成了0价。可见,它们都属于氧化还原反应。C项所有元素化合价都没有发生变化,不属于氧化还原反应。答案:C2.氧化还原反应与四种基本反应类型的关系(1)二者的关系可用具体实例来分析,详见下表:氧化还原反应非氧化还原反应有元素化合价升降的反应没有元素化合价升降的反应化合反应C+O2=====CO22C+O2=====2CO有单质参加CO2+H2O===H2CO3Na2O+H2O===2NaOH没有单质参加分解反应2KClO3=====2KCl+3O2↑有单质生成CaCO3=====CaO+CO2↑没有单质生成置换反应Zn+H2SO4===ZnSO4+H2↑Fe+CuSO4===FeSO4+Cu2CuO+C=====2Cu+CO2↑无复分解反应无2NaOH+H2SO4===Na2SO4+2H2OCaCO3+2HCl===CaCl2+H2O+CO2↑Na2CO3+CaCl2===CaCO3↓+2NaCl(2)通过以上表格的分析,不难总结出氧化还原反应和四种基本反应类型的图示关系,详见下图:①置换反应一定属于氧化还原反应。②复分解反应一定不属于氧化还原反应。③部分化合反应和部分分解反应属于氧化还原反应。【例2】下列反应都能发生,其中既是化合反应,又是氧化还原反应的是()①铁与氯气的反应:2Fe+3Cl2=====2FeCl3②氯气通入NaBr溶液:Cl2+2NaBr===2NaCl+Br2③氯化钠固体与浓硫酸混合加热:2NaCl+H2SO4(浓)=====Na2SO4+2HCl↑④二氧化锰与浓盐酸反应:MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O⑤氧化钙与水反应:CaO+H2O===Ca(OH)2A.只有①②B.只有①③C.只有①④D.只有①解析:根据反应物和生成...