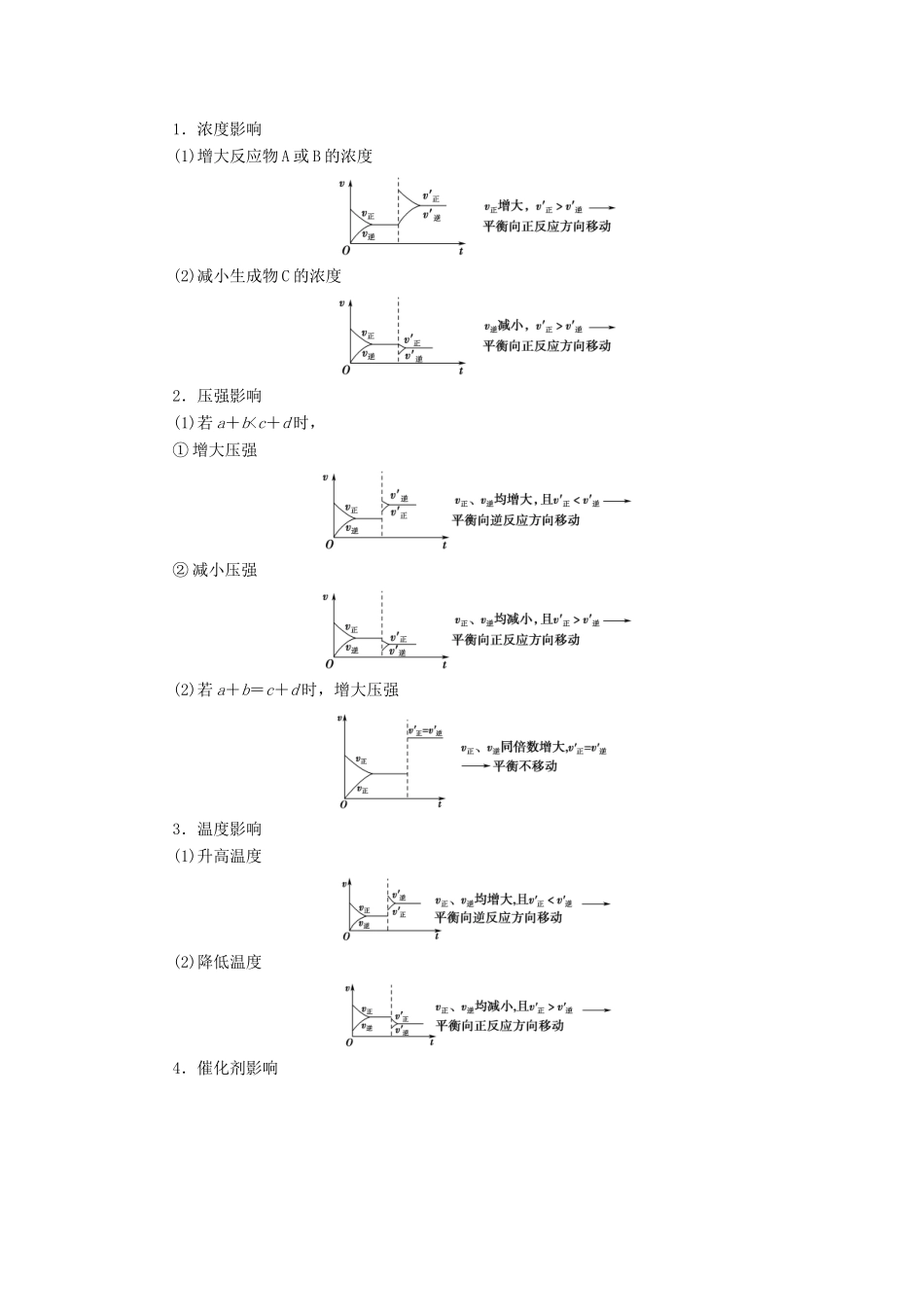
课时2影响化学平衡移动的因素目标与素养:1.明确化学平衡移动的概念,会根据速率变化判断化学平衡的移动方向。(宏观辨识与平衡思想)2.理解外界条件(浓度、温度、压强等)对化学平衡的影响。(科学探究与平衡思想)3.了解催化剂在生活、生产和科学领域中的重要作用。(科学精神和社会责任)1.化学平衡移动(1)含义:当一个可逆反应达到平衡后,如果改变浓度、温度、压强等反应条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到新的平衡。(2)平衡移动方向的判断条件改变(3)图示――→――→――→改变条件,v正、v逆均改变,平衡一定移动吗?[答案]不一定。2.外界条件对化学平衡的影响(1)浓度①对于平衡:Cr2O+H2O2CrO+2H+,加入稀H2SO4,c(H+)增大,溶液颜色变为橙色,平衡向逆反应方向移动,加入NaOH溶液,c(H+)减小,溶液颜色变为黄色,平衡向正反应方向移动。②对于平衡:Fe3++3SCN-Fe(SCN)3,加饱和FeCl3溶液,平衡向正反应方向移动,溶液颜色变深。③影响规律a.增大反应物浓度或减小生成物浓度,平衡向正反应方向移动。b.增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。(2)压强①适用对象:有气体参加的可逆反应。②影响规律当其他条件不变时:a.若为体积不等的反应增大压强,平衡向气体体积减小的方向移动;减小压强,平衡向气体体积增大的方向移动。b.若为等体积反应增大压强时,v正、v逆同等程度地增大;减小压强时,v正、v逆同等程度地减小,平衡均不发生移动。(3)温度①对于2NO2(g)N2O4(g)ΔH=-56.9kJ·mol-1,将NO2球放入冰水中,红棕色变浅,平衡向正反应方向移动;放入热水中,红棕色变深,平衡向逆反应方向移动。②影响规律升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。(4)催化剂催化剂对化学平衡无影响,原因是催化剂同等程度地改变正、逆反应速率。但是使用催化剂,能改变反应到达平衡所需的时间。3.勒夏特列原理:如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。1.判断正误(正确的打“√”,错误的打“×”)(1)改变条件,v正>v逆时平衡正向移动。()(2)增大压强或升高温度,化学平衡均一定移动。()(3)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动。()[答案](1)√(2)×(3)×2.在一定条件下的溶液中,反应FeCl3+3KSCNFe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是()A.加压B.加入少量FeCl3固体C.加入少量KCl溶液D.加入少量氢氧化钠固体[答案]B3.反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:(1)增加Fe的量,其正反应速率________(填“增大”“不变”或“减小”,下同),平衡________移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。(2)将容器的体积缩小一半,其正反应速率________,平衡________移动。(3)保持体积不变,充入N2使体系压强增大,其正反应速率________,平衡________移动。(4)保持体积不变,充入水蒸气,其正反应速率________,平衡________移动。[答案](1)不变不(2)增大不(3)不变不(4)增大向正反应方向外界条件对平衡影响的vt图像以aA(g)+bB(g)cC(g)+dD(g)ΔH<0为例1.浓度影响(1)增大反应物A或B的浓度(2)减小生成物C的浓度2.压强影响(1)若a+b