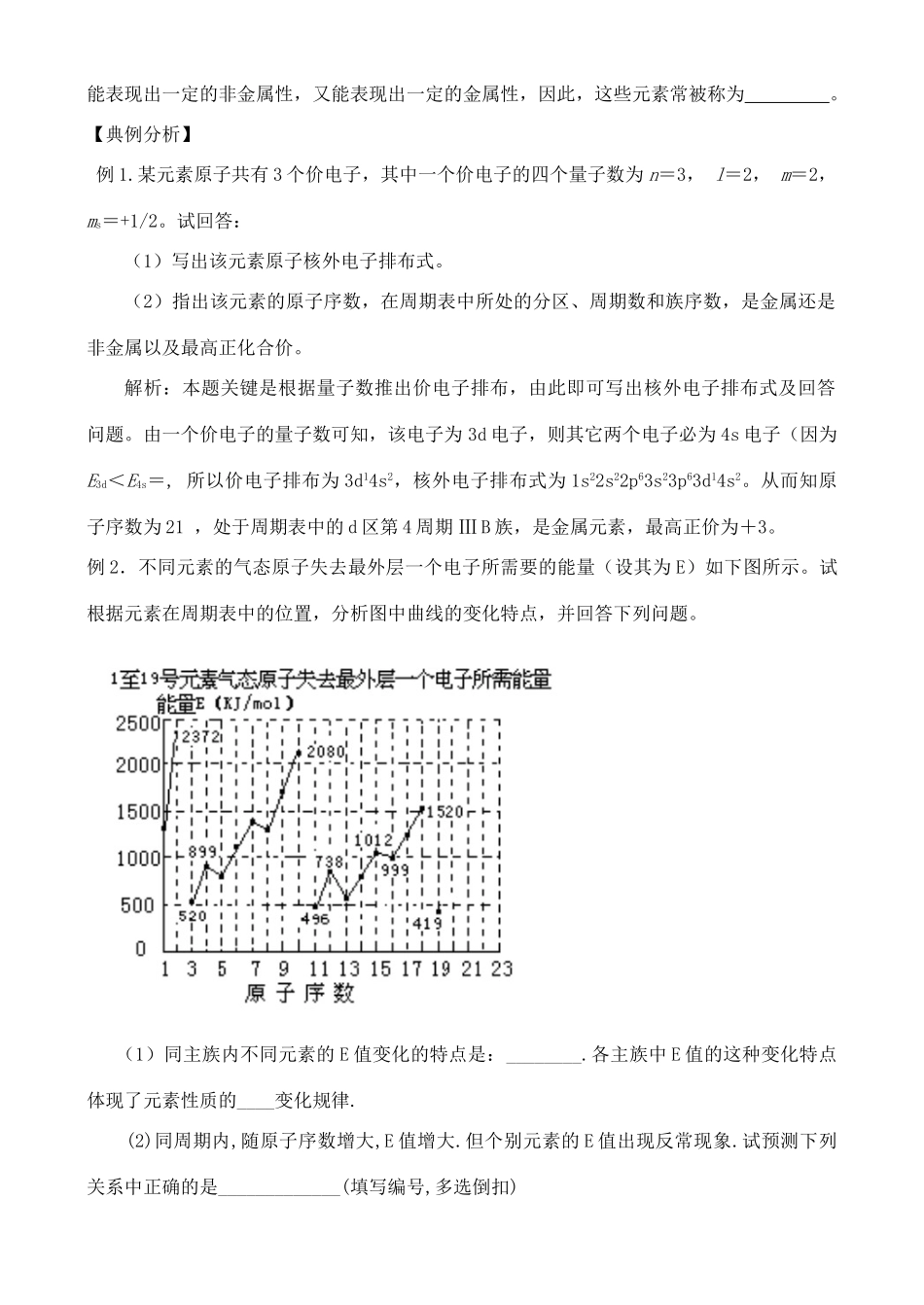
第一章原子结构第二节原子结构与元素周期表第三课时【学习目标】1.了解原子半径的周期性变化,2.能用原子结构的知识解释主族元素原子半径周期性变化的原因;【学习过程】二、核外电子排布与原子半径1.定义:。包括共价半径,金属半径,范氏(范德华)半径。共价半径:叫该原子的共价半径。金属半径:叫做原子的金属半径。范氏(范德华)半径:。(稀有气体的原子半径)在一般的资料里,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。2.原子半径递变规律(1)同周期主族元素从左到右,原子半径逐渐。其主要原因是由于核电荷数的增加使原子核对电子的引力增加而带来原子半径的趋势于增加电子后电子间斥力增大带来原子半径的趋势。(2)同主族元素从上到下,原子半径逐渐。其主要原因是由于电子层数,电子间的斥力使原子半径。(3)同一周期的过渡元素,自左到右原子半径的减小幅度越来越小,因为增加的电子都分布在内层d轨道上,它对与大致相当,使的变化幅度不大。(4)由于元素的金属性和非金属性之间并没有严格的界线,处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此,这些元素常被称为。【典例分析】例1.某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3,l=2,m=2,ms=+1/2。试回答:(1)写出该元素原子核外电子排布式。(2)指出该元素的原子序数,在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价。解析:本题关键是根据量子数推出价电子排布,由此即可写出核外电子排布式及回答问题。由一个价电子的量子数可知,该电子为3d电子,则其它两个电子必为4s电子(因为E3d<E4s=,所以价电子排布为3d14s2,核外电子排布式为1s22s22p63s23p63d14s2。从而知原子序数为21,处于周期表中的d区第4周期ⅢB族,是金属元素,最高正价为+3。例2.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。(1)同主族内不同元素的E值变化的特点是:________.各主族中E值的这种变化特点体现了元素性质的____变化规律.(2)同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系中正确的是_____________(填写编号,多选倒扣)①E(砷)>E(硒)②E(砷)E(硒)④E(溴)