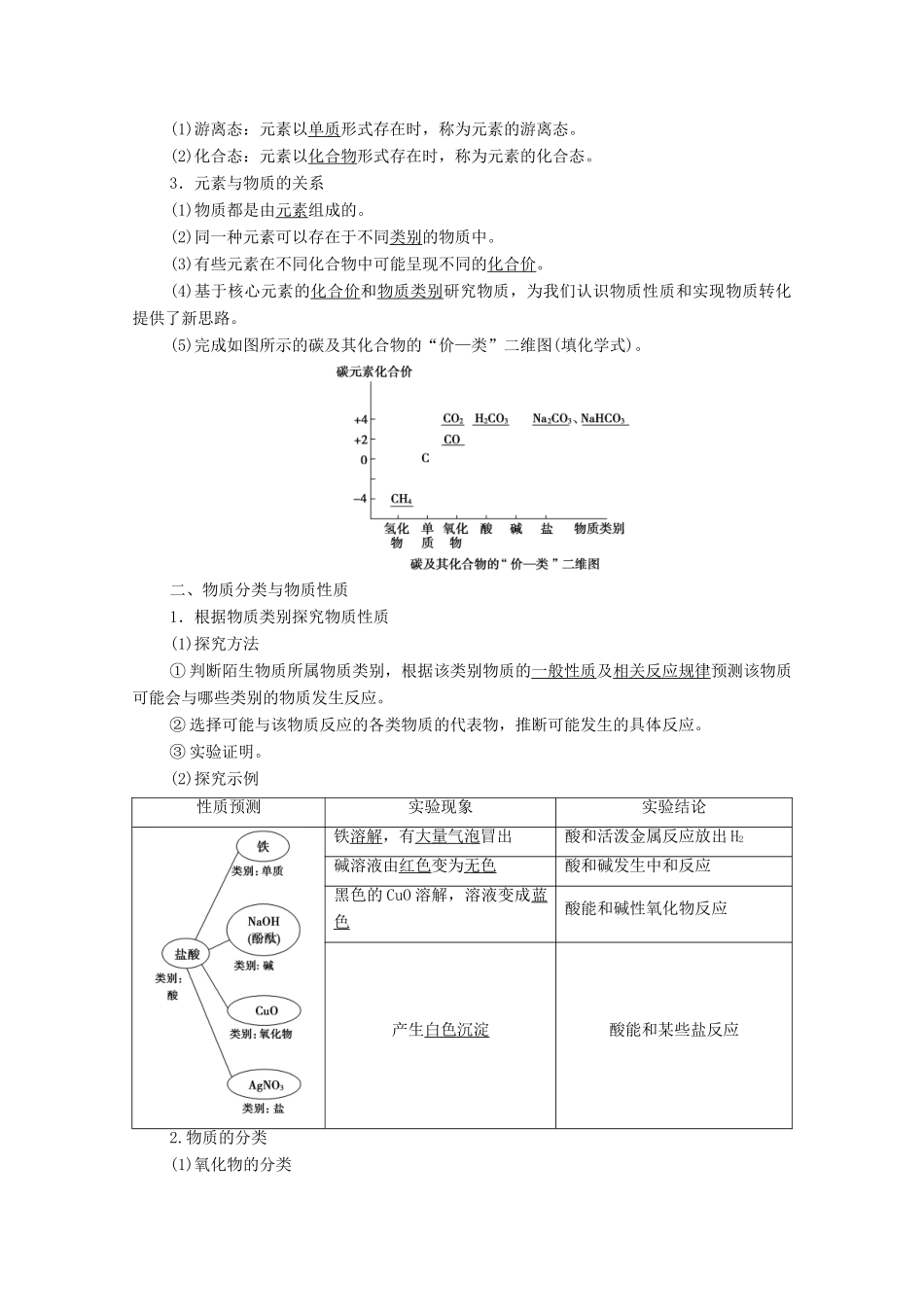
第1课时元素与物质的关系物质分类与物质性质发展目标体系构建1.初步感知各种元素及其化合物,知道元素有游离态和化合态两种形态。2.通过分析身边常见的各种含碳元素的物质,初步基于核心元素认识物质世界,能通过物质类别和元素价态构建元素的物质家族。3.知道分类是研究物质性质的重要方法,根据元素组成可以将物质分为单质、化合物,化合物又可以分为氧化物、酸、碱、盐等。4.认识金属、酸、碱、盐等各类别物质的一般性质,发展对酸性氧化物、碱性氧化物的认识;形成研究一类物质性质的思路方法和根据物质类别研究陌生物质的思路方法。物质一、元素与物质的关系1.元素与物质的关系微点拨:只由一种元素组成的物质可能是纯净物(单质),也有可能是混合物,如C60和石墨的混合物。2.元素的存在形态(1)游离态:元素以单质形式存在时,称为元素的游离态。(2)化合态:元素以化合物形式存在时,称为元素的化合态。3.元素与物质的关系(1)物质都是由元素组成的。(2)同一种元素可以存在于不同类别的物质中。(3)有些元素在不同化合物中可能呈现不同的化合价。(4)基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。(5)完成如图所示的碳及其化合物的“价—类”二维图(填化学式)。二、物质分类与物质性质1.根据物质类别探究物质性质(1)探究方法①判断陌生物质所属物质类别,根据该类别物质的一般性质及相关反应规律预测该物质可能会与哪些类别的物质发生反应。②选择可能与该物质反应的各类物质的代表物,推断可能发生的具体反应。③实验证明。(2)探究示例性质预测实验现象实验结论铁溶解,有大量气泡冒出酸和活泼金属反应放出H2碱溶液由红色变为无色酸和碱发生中和反应黑色的CuO溶解,溶液变成蓝色酸能和碱性氧化物反应产生白色沉淀酸能和某些盐反应2.物质的分类(1)氧化物的分类①酸性氧化物:能与碱反应生成盐和水的氧化物。部分酸性氧化物还可与水和碱性氧化物分别发生化学反应。如:CO2(少量)+2NaOH===Na2CO3+H2O;CO2+H2O===H2CO3;CO2+Na2O===Na2CO3。②碱性氧化物:能与酸反应生成盐和水的氧化物。部分碱性氧化物还可与水和酸性氧化物分别发生化学反应。如:CaO+2HCl===CaCl2+H2O;CaO+H2O===Ca(OH)2;CaO+CO2===CaCO3。(2)其他分类方法1.判断正误(正确的打“√”,错误的打“×”)。(1)CuSO4·5H2O是混合物。()(2)盐酸是化合物。()(3)含有氧元素的化合物都是氧化物。()(4)相同种类的元素可以形成不同的化合物。()[答案](1)×(2)×(3)×(4)√2.下列物质中属于纯净物、化合物、钙盐的是()A.生石灰B.熟石灰C.碳酸钙D.石灰石[答案]C3.下列物质不属于酸性氧化物的是()A.SO3B.CO2C.COD.P2O5C[CO不与碱反应生成盐和水。]物质的分类到目前为止,人们发现的元素只有118种,但就是这118种元素,组成了种类繁多的物质,形成了神秘的宇宙和丰富多彩的物质世界。1.纯净物与混合物的本质区别是什么?提示:纯净物是由同种物质组成的,具有一定的组成,可以用一种化学式来表示,有固定的熔、沸点;混合物是由不同物质组成的,没有一定的组成,不能用一种化学式来表示,无固定的熔、沸点。2.元素的存在形态与物质类别有什么关系?提示:3.Na2O2是碱性氧化物吗?说明理由。提示:不是。Na2O2与酸反应时,不仅生成盐和水,同时还生成氧气,不符合碱性氧化物的概念。4.金属氧化物都是碱性氧化物吗?碱性氧化物都是金属氧化物吗?提示:金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物;碱性氧化物都是金属氧化物。5.非金属氧化物一定是酸性氧化物吗?酸性氧化物一定是非金属氧化物吗?提示:非金属氧化物不一定是酸性氧化物,如CO、NO为不成盐氧化物;酸性氧化物不一定是非金属氧化物,如Mn2O7。微点拨:根据不同的需要可将物质分成不同的类别。例如:根据电离出H+的能力,酸可分为强酸、中强酸和弱酸;根据电离出OH-的能力,碱可分为强碱、中强碱、弱碱。1.下列物质的分类合理的是()A.氧化物:CO2、NO、SO2、H2O、Na2OB.碱:NaOH、KOH、Ba(OH)2、Na2CO3C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2OD.碱性氧化物:Na2O、CaO...