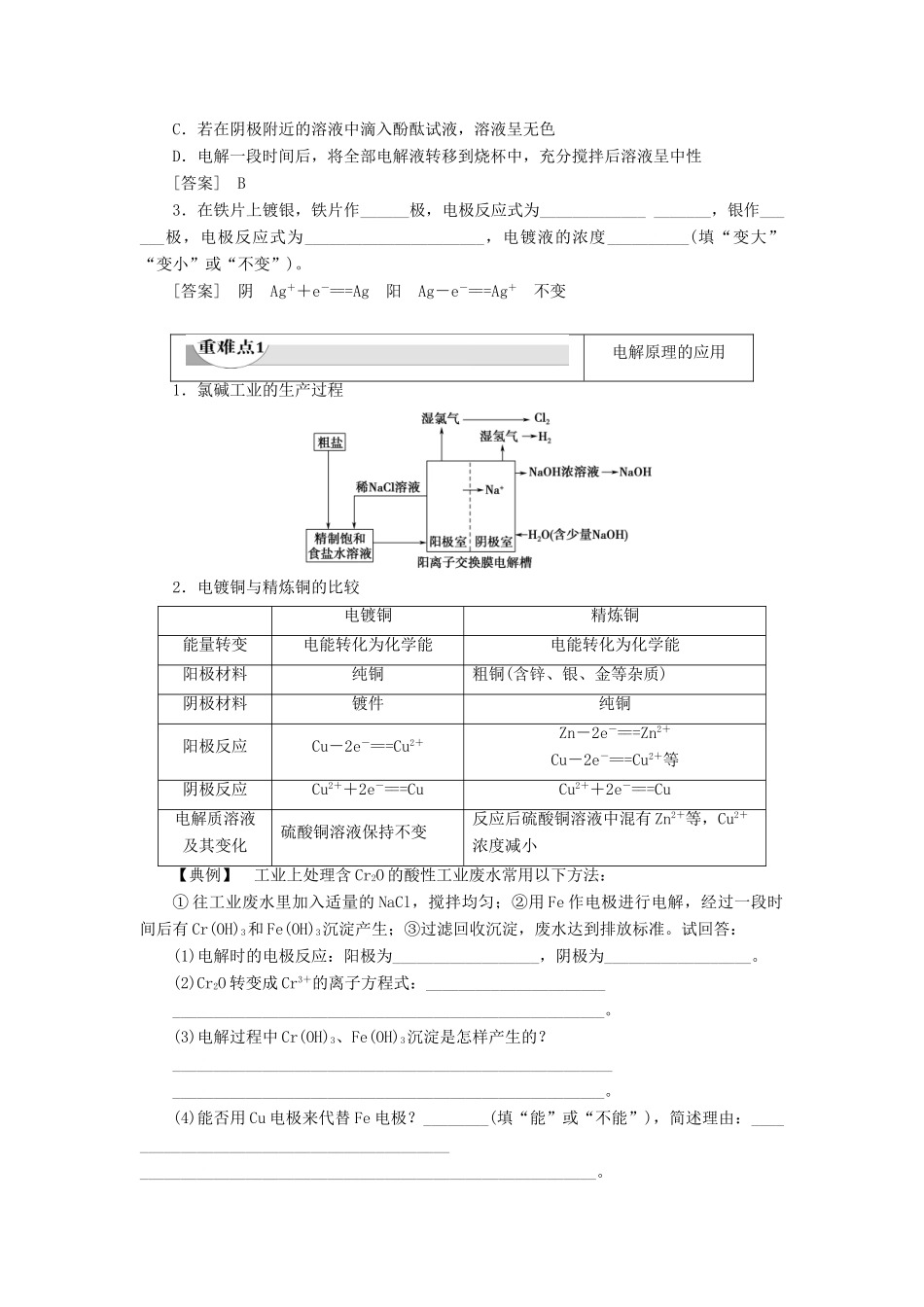
课时2电解原理的应用目标与素养:1.了解电解原理的应用—氯碱工业、精炼、冶金和废水处理等。(宏观辨识与社会责任)2.以电子守恒的观点进行电化学计算。(科学探究与模型认知)1.氯碱工业:电解饱和食盐水,制取烧碱、氯气和氢气。(1)电极反应式(并注明反应类型)阳极:2Cl--2e-===Cl2↑(氧化反应);阴极:2H++2e-===H2↑(还原反应)。其中阴极反应中的H+是由水电离产生的。(2)总反应式:2NaCl+2H2O=====2NaOH+H2↑+Cl2↑。2.电镀(1)电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。(2)电镀3.电解精炼(如电解精炼铜,杂质为铁、锌、金、银等)(1)粗铜作阳极,主要的电极反应为Cu-2e-===Cu2+;纯铜作阴极,电极反应为Cu2++2e-===Cu;电解质溶液为CuSO4溶液。(2)活泼性较强的铁、锌等以离子形式进入溶液,活泼性较差的Ag、Au形成阳极泥。4.电冶金制取金属K、Ca、Na、Mg、Al等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到。(1)电解熔融的氯化钠可以得到金属钠:阴极:2Na++2e-===2Na,阳极:2Cl--2e-===Cl2↑,总反应式:2NaCl(熔融)=====2Na+Cl2↑。(2)电解熔融Al2O3制Al,冰晶石(Na3AlF6)作熔剂。阴极:4Al3++12e-===4Al,阳极:6O2--12e-===3O2↑。总反应式:2Al2O3(熔融)=====4Al+3O2↑。1.判断正误(正确的打“√”,错误的打“×”)(1)石墨电极电解饱和食盐水,阳极附近生成NaOH。()(2)利用电解法可以实现Cu+2H+===Cu2++H2↑。()(3)电镀铜时应将铜连接电源的负极作阴极。()(4)电解精炼粗Cu时,电解质溶液浓度不变。()[答案](1)×(2)√(3)×(4)×2.关于电解饱和NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性[答案]B3.在铁片上镀银,铁片作______极,电极反应式为____________________,银作______极,电极反应式为______________________,电镀液的浓度__________(填“变大”“变小”或“不变”)。[答案]阴Ag++e-===Ag阳Ag-e-===Ag+不变电解原理的应用1.氯碱工业的生产过程2.电镀铜与精炼铜的比较电镀铜精炼铜能量转变电能转化为化学能电能转化为化学能阳极材料纯铜粗铜(含锌、银、金等杂质)阴极材料镀件纯铜阳极反应Cu-2e-===Cu2+Zn-2e-===Zn2+Cu-2e-===Cu2+等阴极反应Cu2++2e-===CuCu2++2e-===Cu电解质溶液及其变化硫酸铜溶液保持不变反应后硫酸铜溶液中混有Zn2+等,Cu2+浓度减小【典例】工业上处理含Cr2O的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe作电极进行电解,经过一段时间后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:(1)电解时的电极反应:阳极为__________________,阴极为__________________。(2)Cr2O转变成Cr3+的离子方程式:___________________________________________________________________________。(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?___________________________________________________________________________________________________________。(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由:__________________________________________________________________________________________________。[解析]由于Cr(+6价)的化合物毒性远高于Cr(+3价)的化合物,将Cr(+6价)转化为Cr(+3价),对废水进行处理是电化学知识在实际生活中的具体运用。在处理有关问题时,应注意思维的有序性:首先应考虑溶液中阴、阳离子的定向移动;然后再考虑阴、阳极按放电顺序可能发生的电极反应。阴极:2H++2e-===H2↑,阳极:Fe-2e-===Fe2+,产生的Fe2+在向阴极移动的过程中与向阳极移动的Cr2O相遇,发生氧化还原反应:6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O,使Cr2O转化为Cr3+,同时Fe2+也转化为Fe3+,在以...