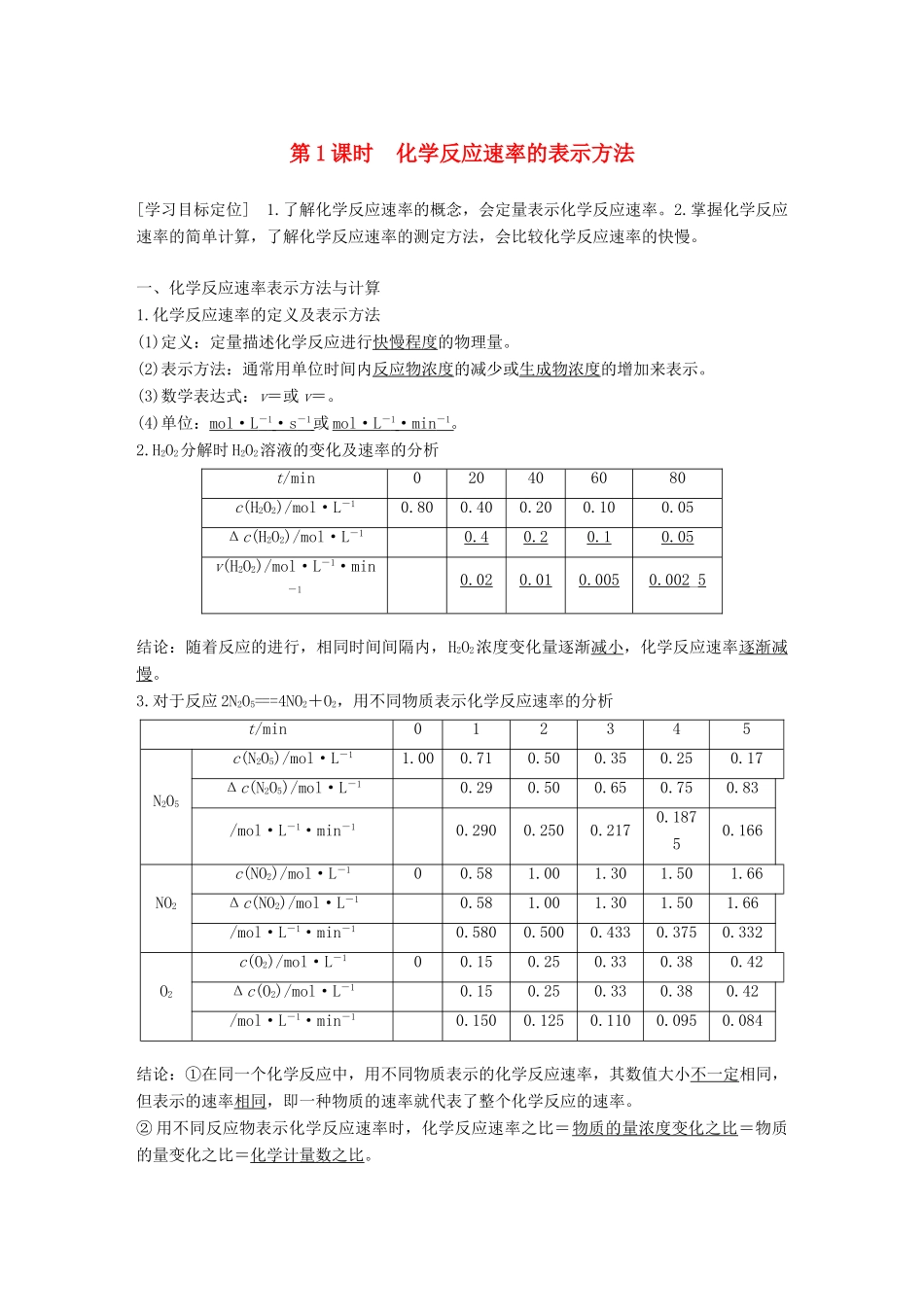
第1课时化学反应速率的表示方法[学习目标定位]1.了解化学反应速率的概念,会定量表示化学反应速率。2.掌握化学反应速率的简单计算,了解化学反应速率的测定方法,会比较化学反应速率的快慢。一、化学反应速率表示方法与计算1.化学反应速率的定义及表示方法(1)定义:定量描述化学反应进行快慢程度的物理量。(2)表示方法:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。(3)数学表达式:v=或v=。(4)单位:mol·L-1·s-1或mol·L-1·min-1。2.H2O2分解时H2O2溶液的变化及速率的分析t/min020406080c(H2O2)/mol·L-10.800.400.200.100.05Δc(H2O2)/mol·L-10.40.20.10.05v(H2O2)/mol·L-1·min-10.020.010.0050.002_5结论:随着反应的进行,相同时间间隔内,H2O2浓度变化量逐渐减小,化学反应速率逐渐减慢。3.对于反应2N2O5===4NO2+O2,用不同物质表示化学反应速率的分析t/min012345N2O5c(N2O5)/mol·L-11.000.710.500.350.250.17Δc(N2O5)/mol·L-10.290.500.650.750.83/mol·L-1·min-10.2900.2500.2170.18750.166NO2c(NO2)/mol·L-100.581.001.301.501.66Δc(NO2)/mol·L-10.581.001.301.501.66/mol·L-1·min-10.5800.5000.4330.3750.332O2c(O2)/mol·L-100.150.250.330.380.42Δc(O2)/mol·L-10.150.250.330.380.42/mol·L-1·min-10.1500.1250.1100.0950.084结论:①在同一个化学反应中,用不同物质表示的化学反应速率,其数值大小不一定相同,但表示的速率相同,即一种物质的速率就代表了整个化学反应的速率。②用不同反应物表示化学反应速率时,化学反应速率之比=物质的量浓度变化之比=物质的量变化之比=化学计量数之比。1固体或纯液体的浓度记为常数,Δc=0,因此不用固体或纯液体表示化学反应速率。2化学反应速率是一段时间Δt内的平均反应速率,而不是瞬时反应速率。3无论是反应物还是生成物,其化学反应速率均取正值。4在描述或计算某物质表示的化学反应速率大小时,必须注明其单位,否则毫无意义。例1反应4A(s)+3B(g)===2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示正确的是()A.用A表示的反应速率是0.4mol·L-1·min-1B.分别用B、C、D表示的反应速率之比是3∶2∶1C.在2min末的反应速率,用B表示是0.3mol·L-1·min-1D.在2min内的反应速率,用C表示是-0.2mol·L-1·min-1答案B解析化学反应速率是一段时间内的平均反应速率,不是瞬时反应速率,只能取正值;不能用固体或纯液体表示某一反应的反应速率。考点化学反应速率题点化学反应速率的概念例2一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)2NH3(g),2min时测得剩余N21mol,下列化学反应速率不正确的是()A.v(N2)=0.25mol·L-1·min-1B.v(H2)=0.75mol·L-1·min-1C.v(NH3)=1mol·L-1·min-1D.v(NH3)=0.5mol·L-1·min-1答案C解析求化学反应速率,需先求参加反应的物质的物质的量浓度的变化量和反应所耗时间,据物质的量的变化量与体积的比可得出浓度的变化量:N2(g)+3H2(g)2NH3(g)起始量/mol2100变化量/mol2-1322min末量/mol110-32则v(N2)==0.25mol·L-1·min-1,v(H2)==0.75mol·L-1·min-1,v(NH3)==0.5mol·L-1·min-1。考点化学反应速率题点化学反应速率的计算方法点拨计算方法(三段式法)(1)计算模型对于反应:mA(g)+nB(g)===pC(g)+qD(g)。A的浓度为amol·L-1,B的浓度为bmol·L-1,C的浓度为cmol·L-1,D的浓度为dmol·L-1。反应从t0s开始进行至t1s时,A消耗了xmol·L-1,则反应速率可计算如下:例如:反应mA(g)+nB(g)pC(g)+qD(g)起始浓度(mol·L-1)abcd转化浓度(mol·L-1)x某时刻浓度(mol·L-1)a-xb-c+d+v(B)=。(2)注意事项①对反应物:c(起始)-c(转化)=c(某时刻)②对生成物:c(起始)+c(转化)=c(某时刻)例3(2017·沭阳高二期中调研)在不同条件下,分别测得反应2SO2(g)+O2(g)2SO3(g)的化学反应速率,其中表示该反应进行最快的是()A.v(SO2)=4mol·L-1·min-1B.v(O2)=3mol·L-1·min-1C.v(SO2)=0.1mol·L-1·s-1D.v(O2...