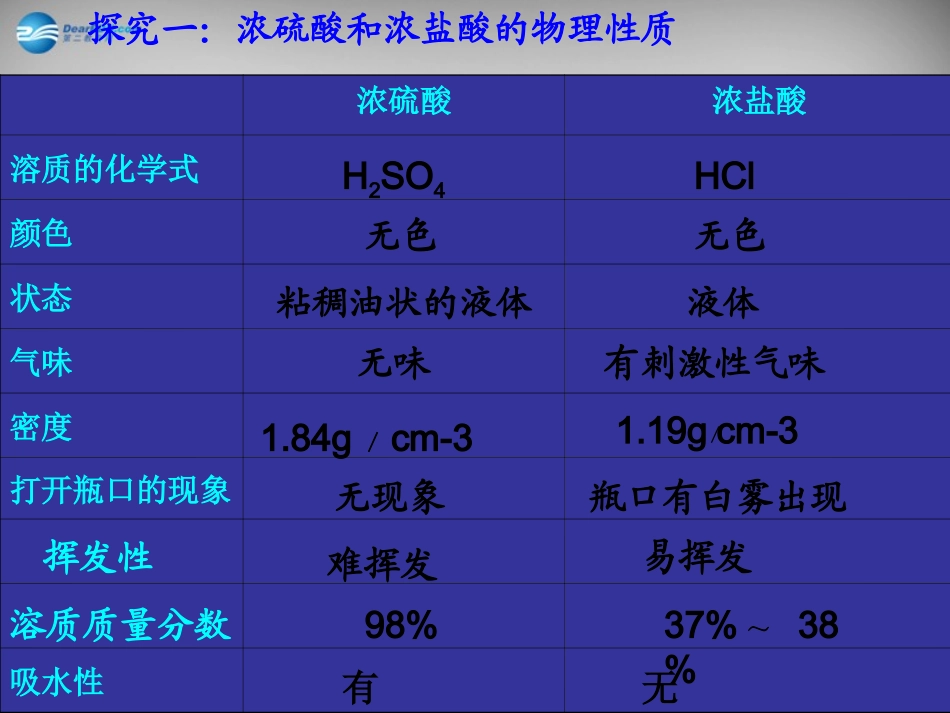
第一节酸及其性质第二单元常见的酸和碱探究一:浓硫酸和浓盐酸的物理性质观察浓硫酸和浓盐酸的状态、颜色,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气味的方法探究一:浓硫酸和浓盐酸的物理性质浓硫酸浓盐酸溶质的化学式颜色状态气味密度打开瓶口的现象吸水性H2SO4HCl无色无色液体粘稠油状的液体有刺激性气味1.84g/cm-3瓶口有白雾出现无现象无味易挥发难挥发1.19g∕cm-3溶质质量分数98%37%~38%挥发性有无因为浓盐酸挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸小液滴的缘故。阅读课本P29快速抢答:为什么打开盛浓盐酸的试剂瓶会看到有白雾出现?阅读《配套》P29,思考:烟和雾的区别浓硫酸有吸水性,可做干燥剂。★浓硫酸有强腐蚀性,会腐蚀衣物和皮肤;若不慎将浓硫酸沾到衣服或皮肤上,你应如何处理?立即用大量的水冲洗,再涂上3%~5%的碳酸氢钠溶液。稀释浓硫酸的方法:浓硫酸沿着器壁慢慢注入水中,而且要不断搅拌。切不可把水倒进浓硫酸里。稀释浓硫酸的方法:思考:为什么?阅读《配套》P29浓硫酸的稀释只能把浓硫酸沿烧杯壁慢慢地倒进水中,并不断搅拌;不能将水倒入浓硫酸里√浓盐酸和浓硫酸长期敞口放置的变化浓盐酸浓硫酸露置在空气中后的溶液质量露置在空气中后的溶质质量露置在空气中后的溶剂质量露置在空气中后的质量分数浓硫酸可作干燥剂:可干燥O2、H2、CO2等气体减小减小增加增加不变不变减小减小浓硫酸的吸水性【解析】干燥原理:【解析】干燥原理:干燥剂只吸收水分,但不能干燥剂只吸收水分,但不能与被干燥的气体发生反应与被干燥的气体发生反应。。思考:1、浓盐酸和浓硫酸应如何保存?为什么?2、常见的酸有哪些?会写化学式。3、酸的组成和构成实验内容现象与结论在稀盐酸分别加入紫色石蕊和无色酚酞镁条、铁丝分别放入稀盐酸中稀盐酸与铁锈作用稀盐酸与硝酸银作用稀盐酸与碳酸钠作用用稀盐酸做几个简单的实验,把观察到的现象填入下表,并写出反应的化学方程式:石蕊:变红酚酞:不变色有气泡产生,第二溶液由无色变为浅绿色铁锈消失,溶液由无色变成黄色硝酸银溶液中产生白色沉淀产生大量气泡Mg+2HCl=MgCl2+H2Fe2O3+6HCl=2FeCl3+3H2OAgNO3+HCl=AgCl+HNO3Na2CO3+2HCl=2NaCl+CO2+H2OFe+2HCl==FeCl2+H2↑氧化铁红铁钉表面有气泡冒出Fe2O3+6HCl==2FeCl3+3H2OFe+2HCl==FeCl2+H2↑铁锈的主要成分是,呈色,放入足量的稀盐酸中,首先观察到,溶液由色变为色;过一会还可看到铁锈逐渐溶解无黄有关反应的化学方程式为:思考:1、什么叫盐?盐和食盐的区别2、什么叫复分解反应?由金属阳离子(或铵根离子)和酸根阴离子构成的化合物叫做盐。两种化合物互相交换成分生成另外两种化合物。这类化学反应叫做复分解反应。活动天地如果把P30中的稀盐酸换成稀硫酸,你认为是否会产生类似的实验现象?试着写出有关反应的化学方程式。Fe2O3+3H2SO4=Fe2(SO4)3+3H2OMg+H2SO4=MgSO4+H2↑Na2CO3+H2SO4=Na2SO4+CO2+H2O↑↑Fe+H2SO4=FeSO4+H21、酸溶液能使紫色石蕊试液变红2、酸+金属=Fe+2HCl=FeCl2+H2↑Mg+2HCl=MgCl2+H2↑3、酸+金属氧化物=Fe2O3+6HCl=2FeCl3+3H2O4、酸+盐=Na2CO3+2HCl=2NaCl+CO2↑+H2OAgNO3+HCl=AgCl↓+HNO3盐+氢气盐+水新酸+新盐Mg+H2SO4=MgSO4+H2↑Fe+H2SO4=FeSO4+H2↑Fe2O3+3H2SO4=Fe2(SO4)3+3H2ONa2CO3+H2SO4=Na2SO4+CO2↑+H2OBaCl2+H2SO4=BaSO4↓+2HCl思考:如何鉴别盐酸和硫酸?加氯化钡溶液,无现象的是盐酸,产生白色沉淀的为硫酸。酸所具有的共同特点:不同的酸在水溶液中都能电离出相同的氢离子(H+),因此酸溶液会具有许多共同的性质。有不同的酸根离子,因此又有不同的化学性质。请你回忆有关知识解释:为什么不同酸的水溶液有共同的化学性质?盐酸HCl=H++Cl-硫酸H2SO4=2H++SO42-你知道吗?【小结】【小结】【小结】【小结】金属+酸=盐+氢气Fe+2HCl==FeCl2+H2↑酸的化学性质酸的化学性质•11、跟紫色石蕊的反应、跟紫色石蕊的反应•22、跟金属的反应、跟金属的反应•33、跟金属氧化物的反应、跟金属氧化物的反应•44、跟某些盐反应、跟某些盐反应石蕊试液遇酸变成石蕊试液遇酸变成红色红色,酚酞,酚酞试液遇酸试液遇酸不变...