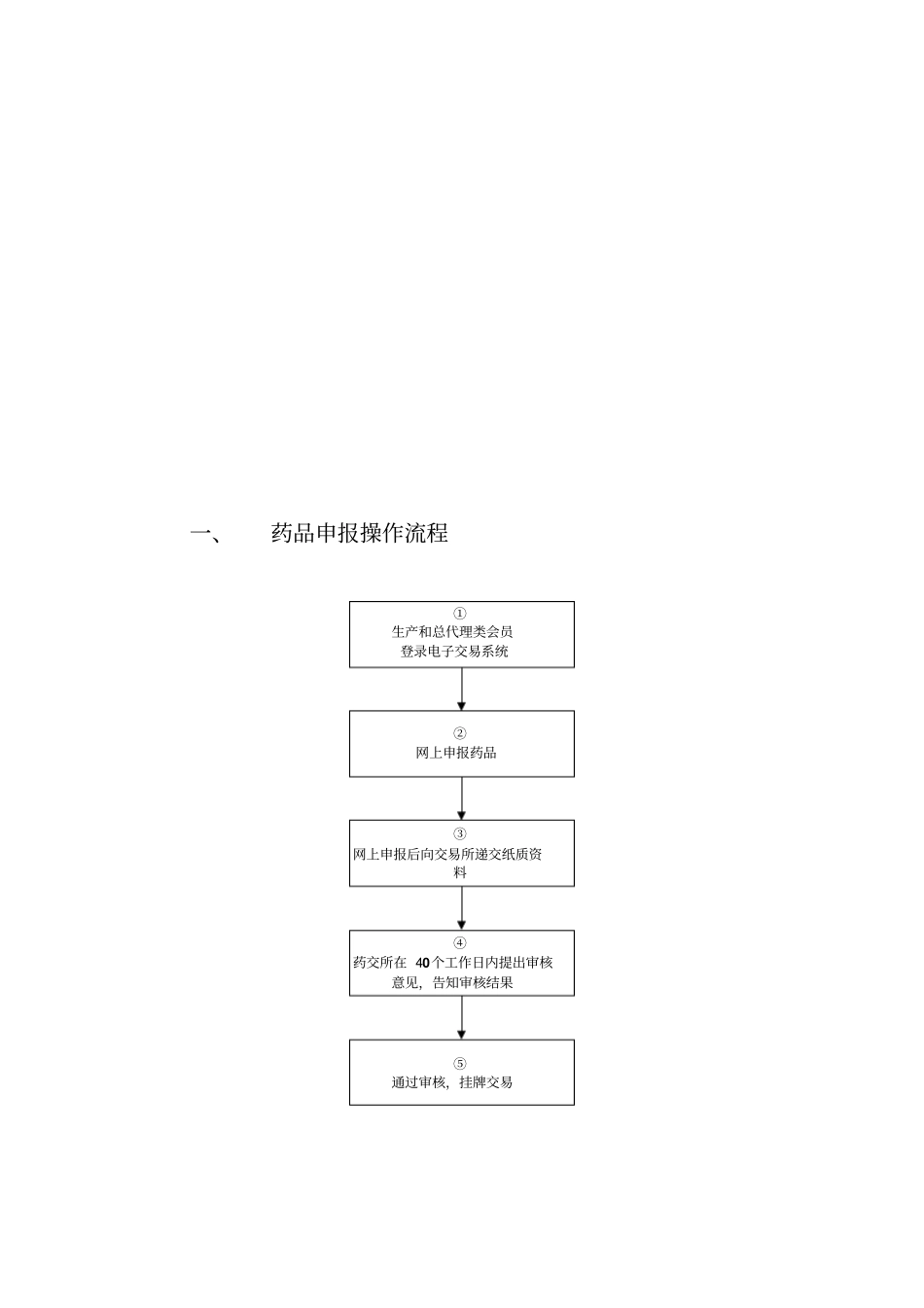
成都医药商品交易所药品申报操作手册一、药品申报操作流程①生产和总代理类会员登录电子交易系统②网上申报药品③网上申报后向交易所递交纸质资料④药交所在40个工作日内提出审核意见,告知审核结果⑤通过审核,挂牌交易二、药品申报操作步骤(一)登录交易系统入口提供两种方式登录药交所交易系统进行药品申报,任选其一:方式一:点击网站首页(http://www.cdyjs.net)(如下图),点击“登录”,打开登录入口,输入正确的用户名、密码、验证码登录。会员登录方式二:登录药交所交易系统http://business.cdyjs.net(如下图),输入正确的用户名、密码、验证码,点击“登录”按钮,进入交易系统。(二)会员登录交易系统成功登录交易系统后,进入会员单位交易系统首页(如下图)。(三)药品申报1.新增药品点击页面左侧菜单栏“药品信息管理”→“药品基本信息列表”(如下图)。药品基本信息列表点击“药品基本信息列表”中“新增”按钮(如下图)进入“药品申报基本信息”页面。2.药品基本信息填写打开“药品申报基本信息”页面(如下图),填写申报药品基本信息。*“药品申报基本信息”页面各项填写说明参见附件一。新增1)填写“通用名”,有以下三种方式:方式一:选择药品通用名。点击“选择药品通用名”进入通用名列表方式二:输入药品通用名首字母拼音。方式三:输入药品通用名中文。2)“相关GMP证书”国产或进口分装的药品,可选择本企业已提交的GMP证书。(如下图)。如需添加GMP证书,则点击输入框右侧“”,进入“证照管理”页面(如下图)。在“证照信息”栏下,“证照类型”选择“GMP认证证书”,依次输入信息,点击“保存”按钮(如下图)。保存成功后,系统会弹出提示窗口,且新保存的GMP证书出现在“证照信息列表”中,显示状态为“初审中”(如下图):返回“药品基本信息列表”页面,刷新当前页面,在“相关GMP证书”列表中可看到新添加的GMP证书:3)新增药品信息填写完成后,点击“保存”按钮(如下图)。4)如下图,系统提示操作成功,该药品加入“药品基本信息列表”。3.增加新品规1)点击药品基本信息管理页面“操作”栏中“”2)点击“确认”按钮(如下图)。3)跳转至“药品管理”页面增加新品规(四)药品申报提交1.完善药品信息进入“药品管理”页面(如下图),如前期申报药品信息不完善,则依次按要求填写、完善药品信息;如药品信息资料完善,则进入提交审核。注释1:“药品管理”页面各项填写说明参见附件二2.不提交,保存药品信息信息部分填写完成,或全部填写完成但需进行校对,暂不提交审核的,则点击“保存草稿”按钮(如下图),所填部分或全部信息即可保存。3.提交审核所有信息填写完成后,点击“提交审核并新增”按钮或“提交审核”按钮。注:①提交审核并新增:将此药品提交审核,并复制该药品内容,继续新增下一个药品品规;②提交审核:将此药品提交审核;③返回:返回至药品管理。4.提交完成后系统提示如下图,提交成功后,弹出提示窗口。药品信息提交审核后,药品信息将不能进行修改,请自行核对填写的药品内容。如下图,新增的两个药品已增加至“药品管理”列表中。(五)打印申报纸质材料将符合药交所要求的纸质资料提交至成都医药商品交易所。步骤一:如下图,点击“药品管理”页面“操作”栏中的“打印”按钮。步骤二:如下图,打印“药品申报信息表”。请牢记系统自动生成的“申报药品编码”。1.附件一:“药品申报基本信息”页面各项填写说明字段说明是否必填生产企业名称生产类会员自动生成,总代理类会员请填写是通用名通过搜索,在结果中选择对应的药品通用名是商品名根据药监局批准内容填写否药品来源生产和总代理类会员请选择:国产、进口、进口分装是进口药品总代理协议进口药品上传经公证的中文翻译件进口总代理类会员必填进口药品总代理有效期进口药品全国总代理会员填写该品种进口药品总代理协议的有效期进口总代理类会员必填国家药品编码本位码填写由国家药监局编制的该药品本位码。如果没有药品本位码,请填写十四个0是药品批准文号填写与药品注册证/再注册证/批件一致的批准文号是药品批准文号附件上传药品注册证/再注册证/批件、进...