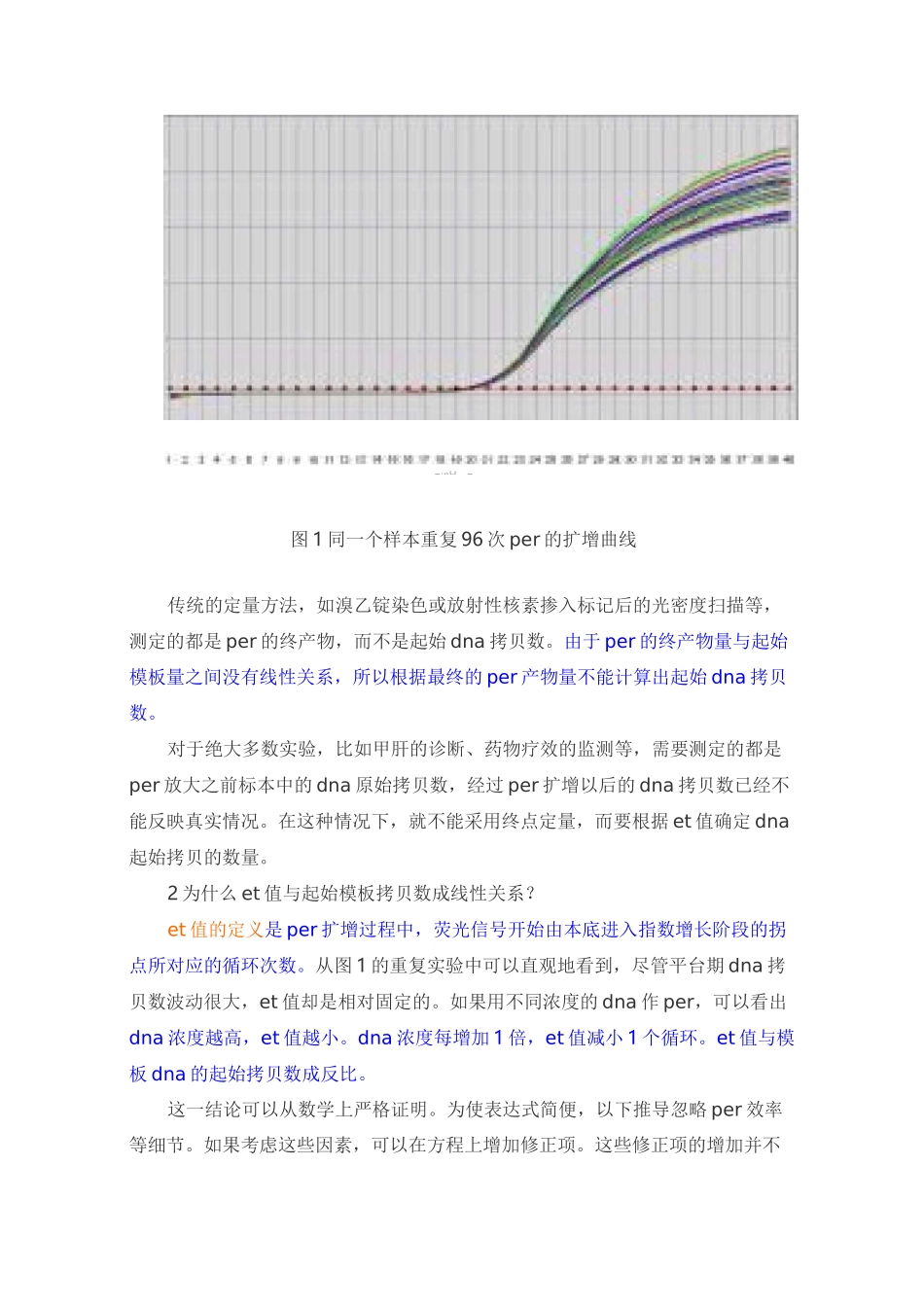
实时荧光定量PCR的原理及实验无论是对遗传病(如地中海贫血和血友病)、传染病(如肝炎和艾滋病)或肿瘤进行基因诊断,还是研究药物对基因表达水平的影响,或者监控药物和疗法的治疗效果,定量per技术都可以发挥很大作用。定量per技术的最新进展是实时荧光定量。该技术借助于荧光信号来检测per产物,一方面提高了灵敏度,另一方面还可以做到per每循环一次就收集一个数据,建立实时扩增曲线,准确地确定et值,从而根据et值确定起始dna拷贝数,做到了真正意义上的dna定量。这是dna定量技术的一次飞跃。根据最终得到的数据不同,定量per可以分为相对定量和绝对定量两种。典型的相对定量如比较经过不同方式处理的两个样本中基因表达水平的高低变化,得到的结果是百分比;绝对定量则需要使用标准曲线确定样本中基因的拷贝数或浓度。根据所使用的技术不同,荧光定量per又可以分为taqman探针和sybrgreeni荧光染料两种方法。比较而言,探针杂交技术在原理上更为严格,所得数据更为精确;荧光染料技术则成本更为低廉,实验设计更为简便。在选择实验方案时要根据实验目的和对数据精度的要求来决定。定量实验与定性实验最大的不同,是要考虑统计学要求并对数据进行严格的校正,以消除偶然误差。因此重复实验和设立内对照非常重要。由于各种各样的客观原因,这一点在实践中往往被轻视或忽视,需要着重强调。当然,与定性实验一样,定量per也要设立阴性和阳性对照,以监控试剂和实验操作方面可能出现的问题。1为什么终点定量不准确?我们都知道理论上per是一个指数增长的过程,但是实际的per扩增曲线并不是标准的指数曲线,而是s形曲线。这是因为随着per循环的增多,扩增规模迅速增大,taq酶、dntp、引物,甚至dna模板等各种per要素逐渐不敷需求,per的效率越来越低,产物增长的速度就逐渐减缓。当所有的taq酶都被饱和以后,per就进入了平台期。由于各种环境因素的复杂相互作用,不同的per反应体系进入平台期的时机和平台期的高低都有很大变化,难以精确控制。所以,即使是重复实验,各种条件基本一致,最后得到的dna拷贝数也是完全不一样的,波动很大(图1)。图1同一个样本重复96次per的扩增曲线传统的定量方法,如溴乙锭染色或放射性核素掺入标记后的光密度扫描等,测定的都是per的终产物,而不是起始dna拷贝数。由于per的终产物量与起始模板量之间没有线性关系,所以根据最终的per产物量不能计算出起始dna拷贝数。对于绝大多数实验,比如甲肝的诊断、药物疗效的监测等,需要测定的都是per放大之前标本中的dna原始拷贝数,经过per扩增以后的dna拷贝数已经不能反映真实情况。在这种情况下,就不能采用终点定量,而要根据et值确定dna起始拷贝的数量。2为什么et值与起始模板拷贝数成线性关系?et值的定义是per扩增过程中,荧光信号开始由本底进入指数增长阶段的拐点所对应的循环次数。从图1的重复实验中可以直观地看到,尽管平台期dna拷贝数波动很大,et值却是相对固定的。如果用不同浓度的dna作per,可以看出dna浓度越高,et值越小。dna浓度每增加1倍,et值减小1个循环。et值与模板dna的起始拷贝数成反比。这一结论可以从数学上严格证明。为使表达式简便,以下推导忽略per效率等细节。如果考虑这些因素,可以在方程上增加修正项。这些修正项的增加并不■:nH—■改变方程的线性性质。一般地,我们有rn=rb+xo(1+ex)nrs,也就是说第n次per循环时的荧光信号强度(rn)等于背景信号强度(rb)加上每个分子的荧光强度(即单位荧光强度,rs)与分子数目的乘积。当循环次数n=et时,则有rt=rb+xo(1+ex)ctrs。两边取对数,得log(rt-rb)=logxO+etlog(1+ex)+logrs。整理此式,etlog(1+ex)=-logxO+log(rt-rb)logrs。所以对于每一个特定的per反应来说,ex、rt、rb和rs都是常数,所以et值与logx0成反比,也就是说,et值与起始模板拷贝数(xO)的对数成反比,起始dna浓度每增加1倍,et值减小1个循环。根据et值的定量是精确和严格的,而传统的终点定量则比较粗放。如果读者有兴趣的话,也可以假设per的效率(即ex)为100%,从上式推算出定量per标准曲线的最佳斜率和et值的最佳范围。3怎样确定et值?实验操作中,et值定义为在...