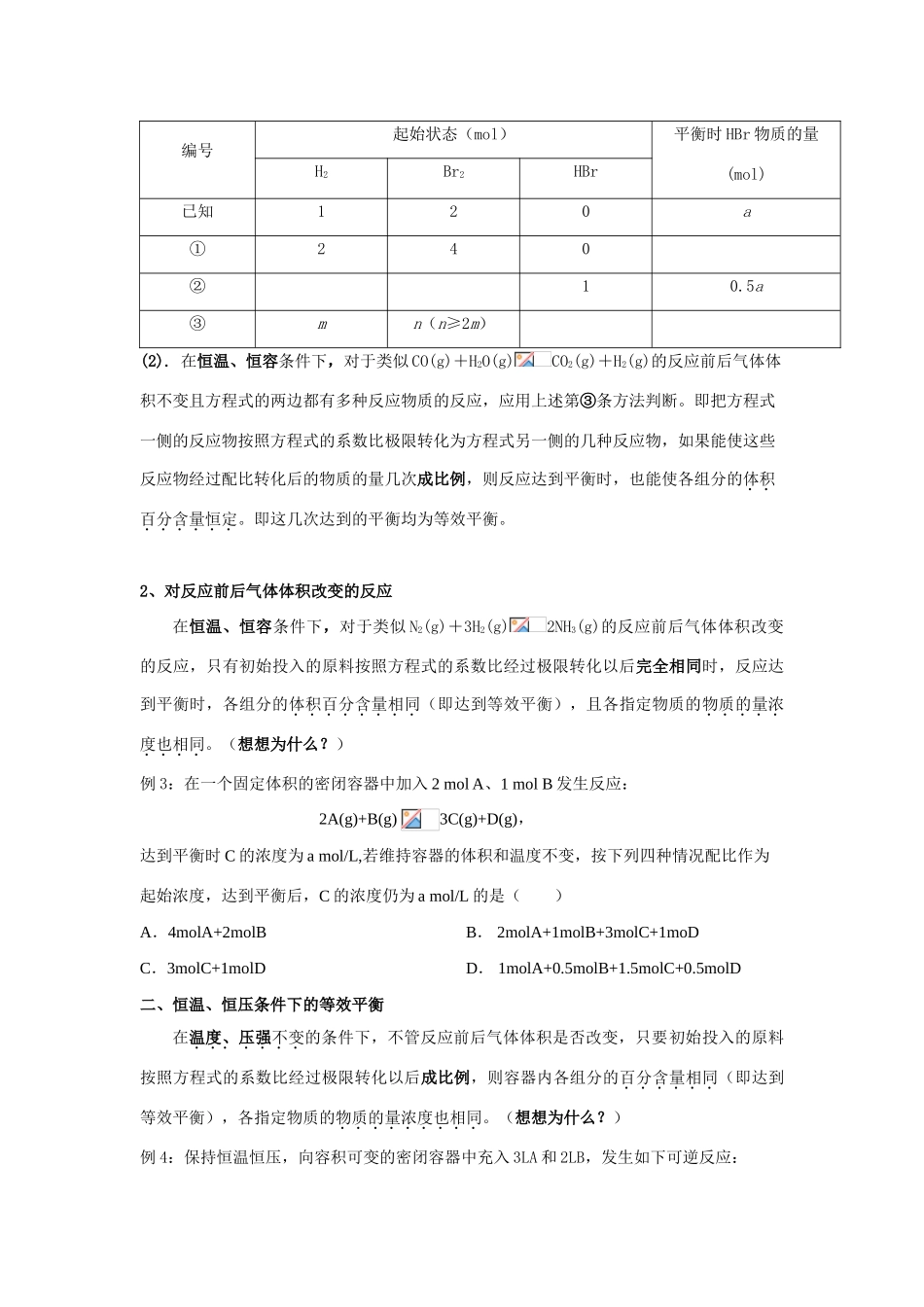
第三节化学平衡(第四部分等效平衡)【知识回顾】等效平衡:同一可逆反应,当外界条件一定时,反应无论从正反应开始,还是从逆反应开始,最后都能达到平衡状态。其中平衡混合物中各同种物质的含量相同(或者是各同种物质的物质的量相同)的平衡状态称为等效平衡。等效平衡一般讨论的是气体反应。一、恒温、恒容条件下的等效平衡1、对反应前后气体体积不变的反应(1).在恒温、恒容条件下,对于类似H2(g)+I2(g)2HI(g)的反应前后气体体积不变且方程式的一边只有一种物质的反应:①如果初始只加入这种单一反应物(如HI),无论初始加入多少量的这种单一反应物(如HI),而另几种反应物的物质的量为0,反应达到平衡时,各组分的体积百分含量恒定。即达到等效平衡。例1:在一定容积的密闭容器内,发生反应:H2(g)+I2(g)2HI(g)。1.若初始时加入1mol的HI,则反应达到平衡时,HI的体积百分含量为W%,HI的浓度为Cmol/L。2.若初始时加入2mol的HI,则反应达到平衡时,HI的体积百分含量W%(大于、小于、或等于),HI的物质的量浓度等于mol/L.(想想为什么?)②如果初始不加入单一反应物(如HI),而同时加入非单一反应物(如加入H2和I2),只要这两次初始加入的反应物的物质的量成比例,反应达到平衡时,各组分的体积百分含量恒定。即达到等效平衡。③如果初始加入的物质既有反应物又有生成物,则把单一反应物按照方程式的系数比极限转化为方程式另一侧的几种反应物,如果能使这些反应物经过配比转化后的物质的量几次成比例,则反应达到平衡时,也能使各组分的体积百分含量恒定。即这几次达到的平衡均为等效平衡。例2:在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2(g)+Br2(g)2HBr(g)。已知加入1molH2和2molBr2时,达到平衡状态生成amolHBr。在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:编号起始状态(mol)平衡时HBr物质的量(mol)H2Br2HBr已知120a①240②10.5a③mn(n≥2m)(2).在恒温、恒容条件下,对于类似CO(g)+H2O(g)CO2(g)+H2(g)的反应前后气体体积不变且方程式的两边都有多种反应物质的反应,应用上述第③条方法判断。即把方程式一侧的反应物按照方程式的系数比极限转化为方程式另一侧的几种反应物,如果能使这些反应物经过配比转化后的物质的量几次成比例,则反应达到平衡时,也能使各组分的体积百分含量恒定。即这几次达到的平衡均为等效平衡。2、对反应前后气体体积改变的反应在恒温、恒容条件下,对于类似N2(g)+3H2(g)2NH3(g)的反应前后气体体积改变的反应,只有初始投入的原料按照方程式的系数比经过极限转化以后完全相同时,反应达到平衡时,各组分的体积百分含量相同(即达到等效平衡),且各指定物质的物质的量浓度也相同。(想想为什么?)例3:在一个固定体积的密闭容器中加入2molA、1molB发生反应:2A(g)+B(g)3C(g)+D(g),达到平衡时C的浓度为amol/L,若维持容器的体积和温度不变,按下列四种情况配比作为起始浓度,达到平衡后,C的浓度仍为amol/L的是()A.4molA+2molBB.2molA+1molB+3molC+1moDC.3molC+1molDD.1molA+0.5molB+1.5molC+0.5molD二、恒温、恒压条件下的等效平衡在温度、压强不变的条件下,不管反应前后气体体积是否改变,只要初始投入的原料按照方程式的系数比经过极限转化以后成比例,则容器内各组分的百分含量相同(即达到等效平衡),各指定物质的物质的量浓度也相同。(想想为什么?)例4:保持恒温恒压,向容积可变的密闭容器中充入3LA和2LB,发生如下可逆反应:3A(气)+2B(气)xC(气)+yD(气)。达到平衡后,C的体积分数为m%。若维持温度和压强不变,将0.6LA,0.4LB,4LC,0.8LD作为起始物质充入该密闭容器,达到平衡时使C的体积分数仍为m%。请回答:能否计算出x、y的值,如果可以,请写出计算过程;如果不能,请说明理由,并写出xy应满足的等量关系。达标练习1一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是A.保持温度和容器体积不变,充入1molSO2(g)B.保持温度和容器内压强不变,充入1molSO3(g)C.保...