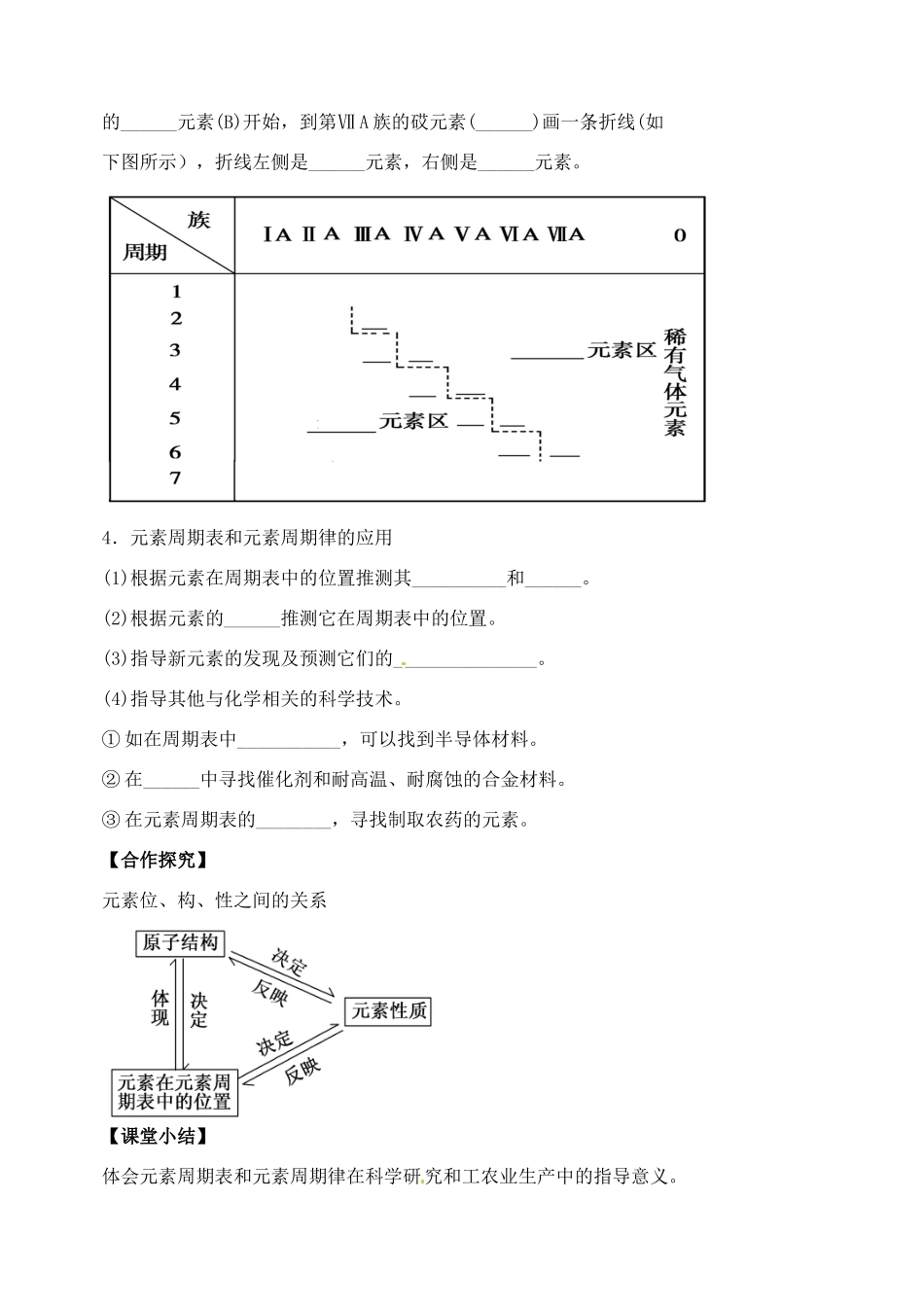
山西省临汾市清华园中学高中化学必修二1.2.3元素周期律学案【学习目标】1.了解元素周期表的简单分区。2.认识周期表是元素周期律的具体表现形式。3.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。【学习重、难点】元素周期律和元素周期表的综合应用【学法指导】概括总结【导入新知】我们已经学习了元素周期表和元素周期律的相关知识,那么,元素周期表和元素周期律对我们的生活有什么指导意义呢?【自主学习】1.元素周期表与元素周期律的关系(1)元素周期表是元素周期律的________形式。(2)可以根据元素在周期表中的位置推测其原子_______和________,也可以根据原子结构推测元素在周期表中的____________。2.元素的化合价与元素在周期表中位置之间的关系(1)主族元素最高正化合价=__________=______________(价电子数)(2)非金属元素①最高正价=原子所能失去或偏移的__________②最低负价=使它达到_____稳定结构所需得到电子数③最高正价+|最低负价|=____3.元素周期表中金属与非金属的分区金属元素和非金属元素在周期表中有相对明确的分区现象。在元素周期表中从第ⅢA族的______元素(B)开始,到第ⅦA族的砹元素(______)画一条折线(如下图所示),折线左侧是______元素,右侧是______元素。4.元素周期表和元素周期律的应用(1)根据元素在周期表中的位置推测其__________和______。(2)根据元素的______推测它在周期表中的位置。(3)指导新元素的发现及预测它们的_______________。(4)指导其他与化学相关的科学技术。①如在周期表中___________,可以找到半导体材料。②在______中寻找催化剂和耐高温、耐腐蚀的合金材料。③在元素周期表的________,寻找制取农药的元素。【合作探究】元素位、构、性之间的关系【课堂小结】体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。【达标检测】1.在元素周期表中,主族元素自第ⅢA族的硼到第ⅦA族的砹连一条斜线,即为金属和非金属的分界线,从分界线附近可以找到()A.耐高温材料B.新型农药材料C.半导体材料D.新型催化剂材料2.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是()A.同一元素不可能既表现金属性,又表现非金属性B.第三周期元素的最高正化合价等于它所处的主族序数C.短周期元素形成离子后,最外层都达到8电子稳定结构D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同3.下列关于元素周期律的叙述正确的是()A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.元素的性质随着原子序数的递增而呈周期性的变化C.随着原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化4.下列关于元素周期律和元素周期表的论述中正确的是()A.同一主族的元素从上到下单质熔点逐渐升高B.元素周期表是元素周期律的具体表现形式C.同一周期从左到右,元素原子半径逐渐增大D.非金属元素的最高正化合价等于它的负化合价的绝对值5.下列关于元素周期表和元素周期律的说法错误的是()A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C.因为Na比K容易失去电子,所以Na比K的还原性强D.O与S为同主族元素,且O比S的非金属性强6.下列有关原子结构和元素周期律的表述正确的是()①原子序数为15的元素的最高正化合价为+3②第ⅦA族元素是同周期中非金属性最强的元素③第二周期第ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第三周期第ⅡA族A.①②B.①③C.②④D.③④7.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)()A.若R(OH)n为强碱,则W(OH)n+1也为强碱B.若HnXOm为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z的最高正化合价为+6D.若X的最高正化合价为+5,则五种元素都是非金属元素8.6g某金属跟足量盐酸反应产生0.5g氢气,生成的+2价金属氯化物中共有11.5mol电子,则该金属在元...