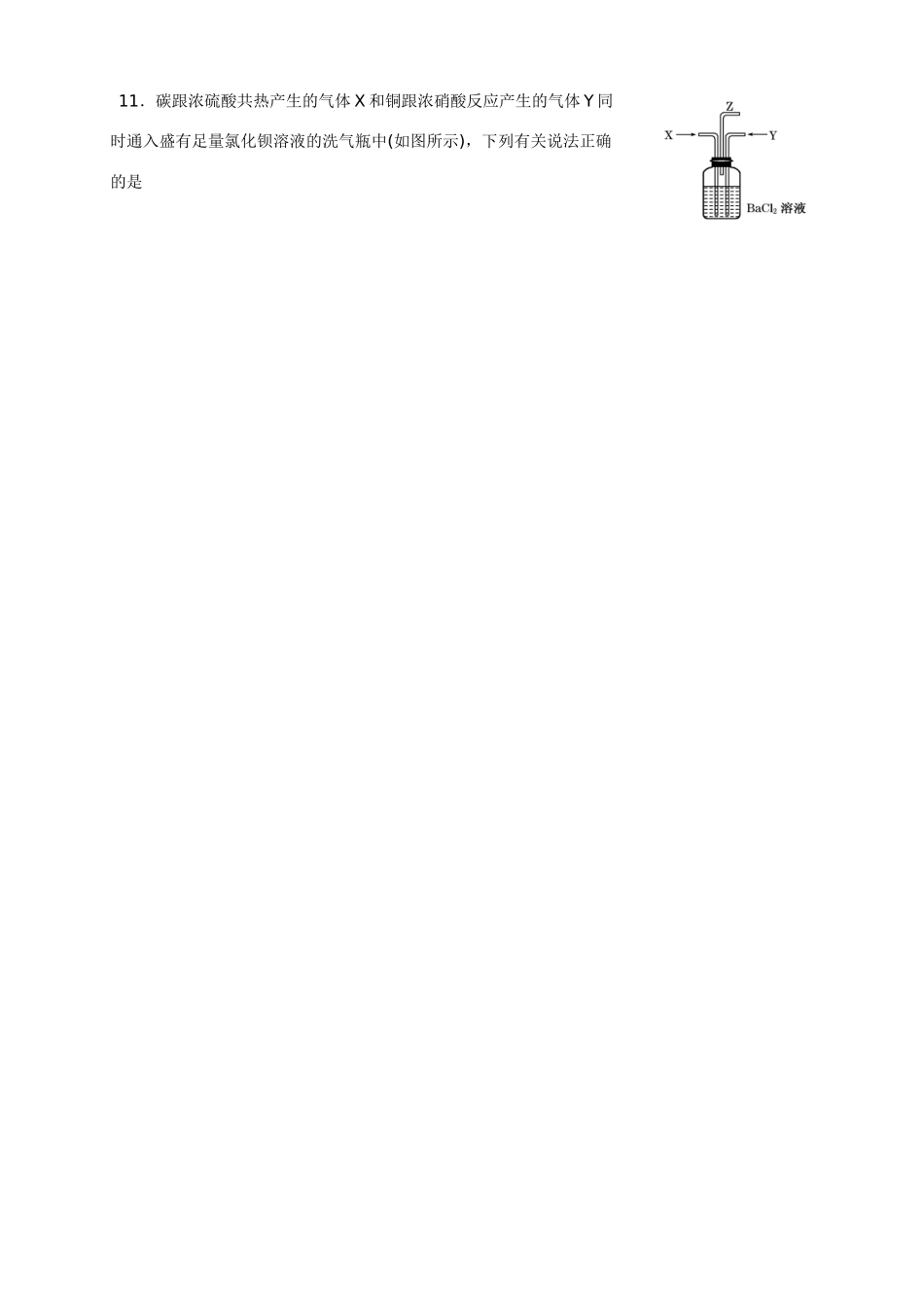
米易中学高一化学4月月考试题可能用到的相对原子质量:H-1C-12N-14O-16Na-23Mg-24Al-27S-32Cl-35.5K-39Ca-40Fe-56Zn-65Cu-64Ⅰ卷(共40分)1.空气是人类生存所必需的重要资源,为改善空气质量而启动的“蓝天工程”得到了全民支持。下列措施不利于“蓝天工程”建设的是()A.推广使用燃煤脱硫技术,防治SO2污染B.实施绿化工程,防治扬尘污染C.研制开发燃料电池汽车,消除机动车尾气污染D.加大石油,煤炭的开采速度,增加化石原料供应量2.下列储存药品的方法中,正确的是()A.浓硫酸保存在橡胶塞试剂瓶中B.浓硝酸保存在无色试剂瓶中C.金属钠保存在煤油中D.纯碱溶液保存在玻璃塞试剂瓶中3.下列反应属于氮的固定的是()A.空气在雷电作用下所产生NOB.NO和O2生成NO2C.铜与浓硝酸反应产生NO2D.NH4Cl与Ca(OH)2反应生成NH34.下列气体不能用排水法收集的是()A.NOB.COC.O2D.NO2[来源:学科网ZXXK]5.检验氨气不可选用()A.湿润的酚酞试纸B.湿润的PH试纸C.蘸有浓盐酸的玻璃棒D.湿润的蓝色石蕊试纸6.下列物质不属于“城市空气质量日报”报道内容的是()A..二氧化硫B.氮氧化物C.二氧化碳D.悬浮颗粒7.硝酸应避光保存是因为它具有A.强酸性B.强氧化性C.挥发性D.不稳定性8.下列关于浓硫酸的叙述中,正确的是()A.浓硫酸具有吸水性,因而能使蔗糖炭化B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化9、检验溶液中的离子或物质,所用方法正确的是()A.向品红溶液中通入某中气体,溶液褪色,证明气体一定SO2B.加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有SO42-C.加入KSCN溶液和H2O2溶液,有血红色生成,证明一定含有Fe3+D.加入浓NaOH溶液后加热,生成使湿润的PH试纸变蓝的气体,证明一定有NH4+10.在一定条件下可以进行如下反应:18H++6RO4n-+5I-→6R2++5IO3-+9H2O,则RO4n-中n的值为()A.1B.2C.3D.411.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是()A.洗气瓶中产生的沉淀是碳酸钡B.从Z导管出来的气体中无二氧化碳C.洗气瓶中产生的沉淀是亚硫酸钡D.在Z导管口有红棕色气体出现12.铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是()A.Fe2(SO4)3B.Na2CO3C.KNO3D.FeSO413、下列化学方程式或离子方程式正确的是()A、常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2OB、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2OC、向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓D、向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O14、已知硫酸的密度随浓度的增加而增大,98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸溶液的物质的量浓度为()A.等于9.2mol/LB.大于9.2mol/LC.小于9.2mol/LD.不能确定15.下列气体中既不能用浓硫酸干燥,又不能用固体NaOH干燥的是()A.Cl2B.O2C.SO2D.H2S16.NA表示阿伏加德罗常数,下列说法正确的是()A.1molNa与足量O2反应生成Na2O或Na2O2均失去2NA个电子B.1molAl分别放入足量冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个C.常温常压下,8gCH4含有的分子数为0.5NAD.标准状况下,11.2LH2O含有的分子数为0.5NA17.如右图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是()A.X是Cl2,Y是NaOH溶液[来源:学科网ZXXK]B.X是HCl,Y是NaCl的稀溶液C.X是SO2,Y是NaOH溶液D.X是CO2,Y是稀硫酸18.在无色透明的强酸性溶液中,能大量共存的离子组是()A.Na+、Mg2+、NO3-、SO32-B.K+、Cl—、NO3-、Fe2+C.NH4+、Al3+、NO3-、SO42-D.K+、Na+、HCO3-、NO3-19.用一充满NO2的烧瓶做喷泉实验,当进入烧瓶中的液面不上升后,烧瓶内的溶质的物质的量浓度是(按标准状况下计算)()A.2/3mol·L-1B.1...