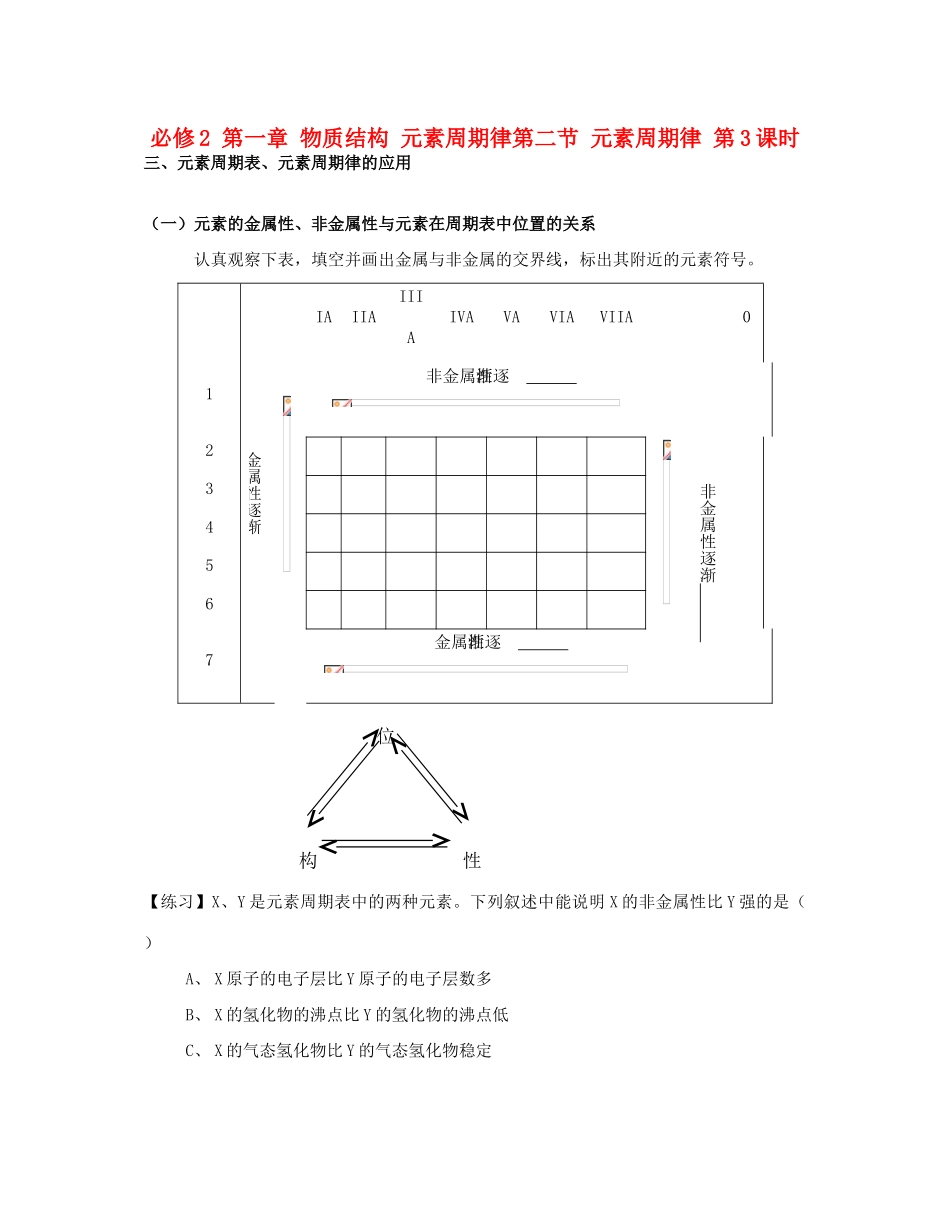
必修2第一章物质结构元素周期律第二节元素周期律第3课时三、元素周期表、元素周期律的应用(一)元素的金属性、非金属性与元素在周期表中位置的关系认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。金属性逐渐IAIIAIIIAIVAVAVIAVIIA01非金属性逐渐非金属性逐渐234567金属性逐渐【练习】X、Y是元素周期表中的两种元素。下列叙述中能说明X的非金属性比Y强的是()A、X原子的电子层比Y原子的电子层数多B、X的氢化物的沸点比Y的氢化物的沸点低C、X的气态氢化物比Y的气态氢化物稳定位构性D、Y的单质能将X从NaX的溶液中置换出来【分析】(二)元素的化合价与元素在周期表中位置的关系思考:1、标出下列有下划线元素的化合价:NaClMgCl2AlCl3H2SiO3H3PO4H2SO4HClO42、总结最高正化合价与什么有直接关系?得出结论:主族元素最高正化合价===思考:写出下列化合物中有下划线元素的化合价:Na2CO3与CH4H2SO4与H2SHCl与HClO4分析最高正化合价与最低负化合价之间的关系,并解释其原因。得出结论:。【练习】某元素X的最高价氧化物对应水化物的化学式为HXO4,则其气态氢化物的化学式为:;若其水溶液呈现酸性,且能与AgNO3溶液反应生成白色沉淀,则它在元素周期表中的位置是:。【分析】(三)元素周期律、元素周期表的应用1、预测未知物的位置与性质【练习】Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是()A、原子半径是第ⅡA族中最大的B、遇冷水能剧烈反应C、位于第七周期D、Ra(OH)2是两性氢氧化物2、寻找所需物质在能找到制造半导体材料,如;在能找到制造农药的材料,如;在能找到作催化剂,耐高温,耐腐蚀的合金材料。【随堂练习】1、在周期表中金属和非金属的分界线附近能找到()A、制农药的元素B、制催化剂的元素C、做半导体的元素D、制耐高温合金材料的元素2、元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是(元素X、Y都为主族元素)。()A、XY2B、X2Y3C、X3Y2D、X2Y3、某元素X的气态氢化物化学式为H2X,下面的叙述不正确的是()A、该元素的原子最外电子层上有6个电子B、该元素最高正价氧化物的化学式为XO2C、该元素是非金属元素D、该元素最高正价氧化物对应水化物的化学式为H2XO4