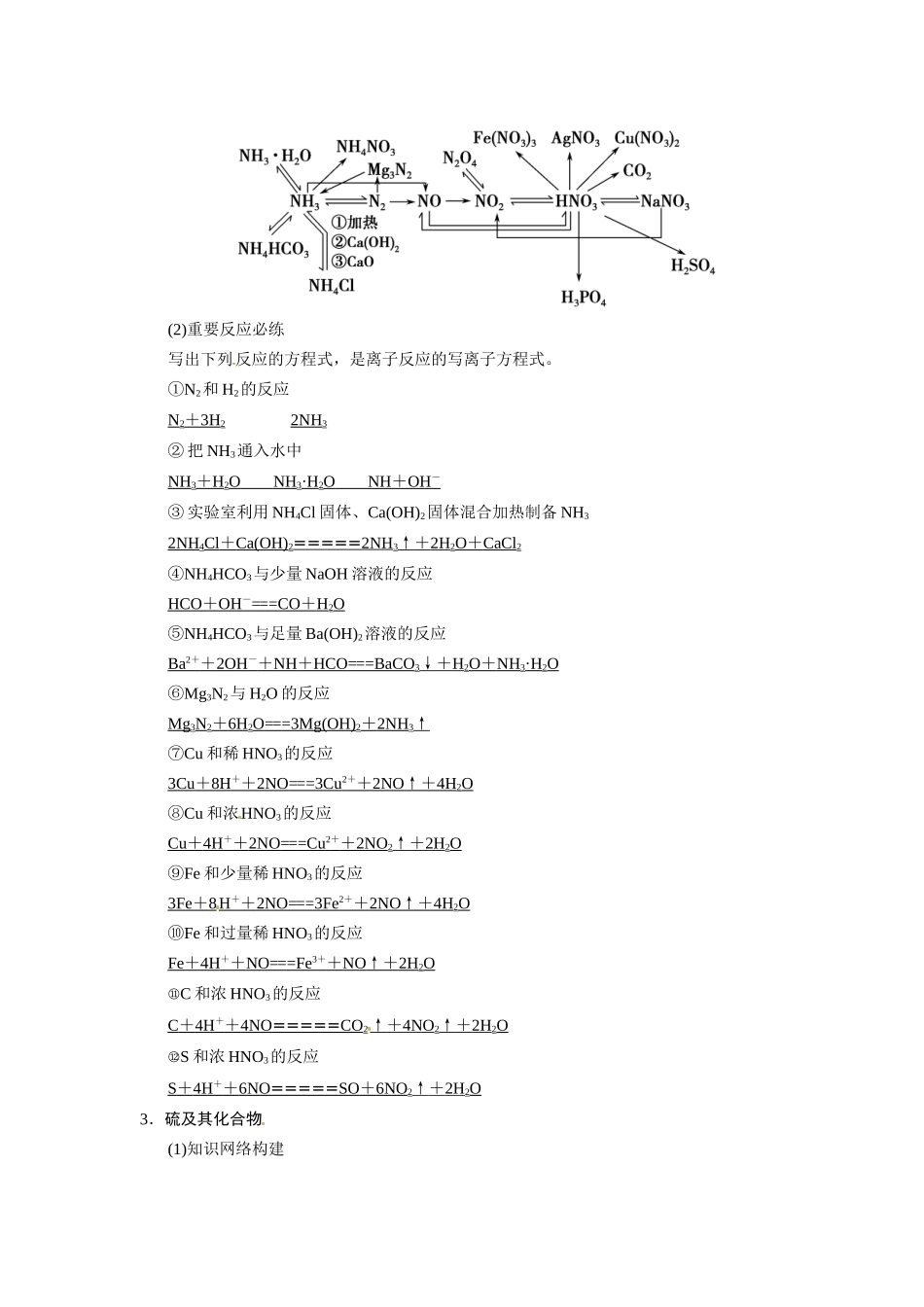
章末回顾排查专练(三)排查一、重要化学反应方程式再书写1.碳及其化合物(1)知识网络构建(2)重要反应必练Ⅰ.请用化学方程式实现上述①~⑩转化关系,体会单质碳、CO、CO2的还原性或氧化性。a.C→CO①2C+O2(不足)=====2CO;②C+H2O(g)=====CO+H2;③2C+SiO2=====2CO↑+Si;b.CO→CO2④2CO+O2=====2CO2;⑤CO+H2O(g)=====CO2+H2;⑥CuO+CO=====Cu+CO2c.CO2→CO⑦CO2+C=====2CO;d.C→CO2⑧C+O2(足量)=====CO2;⑨C+4HNO3(浓)=====CO2↑+4NO2↑+2H2O;e.CO2―→C⑩CO2+2Mg=====2MgO+C。Ⅱ.请用化学方程式或离子方程式实现上述⑪~⑯六个同价态含碳化合物间的转化⑪⑫与过量酸反应:CO+2H+===H2O+CO2↑⑬⑭⑮⑯2.氮及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。①N2和H2的反应N2+3H22NH3②把NH3通入水中NH3+H2ONH3·H2ONH+OH-③实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH32NH4Cl+Ca(OH)2=====2NH3↑+2H2O+CaCl2④NH4HCO3与少量NaOH溶液的反应HCO+OH-===CO+H2O⑤NH4HCO3与足量Ba(OH)2溶液的反应Ba2++2OH-+NH+HCO===BaCO3↓+H2O+NH3·H2O⑥Mg3N2与H2O的反应Mg3N2+6H2O===3Mg(OH)2+2NH3↑⑦Cu和稀HNO3的反应3Cu+8H++2NO===3Cu2++2NO↑+4H2O⑧Cu和浓HNO3的反应Cu+4H++2NO===Cu2++2NO2↑+2H2O⑨Fe和少量稀HNO3的反应3Fe+8H++2NO===3Fe2++2NO↑+4H2O⑩Fe和过量稀HNO3的反应Fe+4H++NO===Fe3++NO↑+2H2O⑪C和浓HNO3的反应C+4H++4NO=====CO2↑+4NO2↑+2H2O⑫S和浓HNO3的反应S+4H++6NO=====SO+6NO2↑+2H2O3.硫及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。①S和热NaOH溶液的反应[3S+6OH-=====2S2-+SO+3H2O②把H2S气体通入CuSO4溶液中H2S+Cu2+===CuS↓+2H+③FeS和稀H2SO4反应FeS+2H+===Fe2++H2S↑④FeS和稀HNO3反应FeS+4H++NO===Fe3++S+NO↑+2H2O⑤将SO2气体通入到氢硫酸中SO2+2H2S===3S↓+2H2O⑥把H2S气体通入到FeCl3溶液中H2S+2Fe3+===S↓+2Fe2++2H+⑦把H2SO4、Na2SO3、Na2S三种溶液混合2S2-+SO+6H+===3S↓+3H2O⑧把SO2气体通入到酸性KMnO4溶液中5SO2+2MnO+2H2O===5SO+2Mn2++4H+⑨Cu和浓硫酸的反应Cu+2H2SO4(浓)=====Cu2++SO+SO2↑+2H2O⑩C和浓硫酸反应C+2H2SO4(浓)=====CO2↑+2SO2↑+2H2O⑪把浓H2SO4滴到Na2SO3固体上H2SO4(浓)+Na2SO3===Na2SO4+H2O+SO2↑⑫将少量NaHSO4溶液滴到Ba(OH)2溶液中H++SO+Ba2++OH-===BaSO4↓+H2O⑬将Ba(OH)2溶液滴加到NaHSO4溶液中至中性Ba2++2OH-+2H++SO===BaSO4↓+2H2O排查二、规范简答再强化1.检验Na2SO3样品部分被氧化的实验操作及现象是:取样品,加入过量稀盐酸,产生有刺激性气味的气体,通入品红溶液,品红溶液退色;再加入BaCl2溶液,产生白色沉淀。2.检验Na2SO4中含有少量NaCl的实验操作及现象是:取少量样品溶于水,加入过量的Ba(NO3)2溶液,静置,取上层清液于试管中,再滴加AgNO3溶液,产生白色沉淀,证明Na2SO4中含有少量NaCl。3.检验NH的实验操作及现象是:取少量试液中加入浓NaOH溶液,加热,把湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明有NH3生成,证明原溶液含有NH。4.SO2能使滴有酚酞的Na2CO3溶液、酸性高锰酸钾溶液、溴水、品红溶液退色,原理相同吗?分别表现了SO2的什么性质?答案原理不相同。SO2能使滴有酚酞的Na2CO3溶液红色退去,是因为发生了反应Na2CO3+2SO2+H2O===2NaHSO3+CO2,表现了SO2酸性氧化物的性质;SO2能使酸性高锰酸钾溶液、溴水退色,表现了SO2的还原性;SO2能使品红溶液退色,表现了SO2的漂白性。