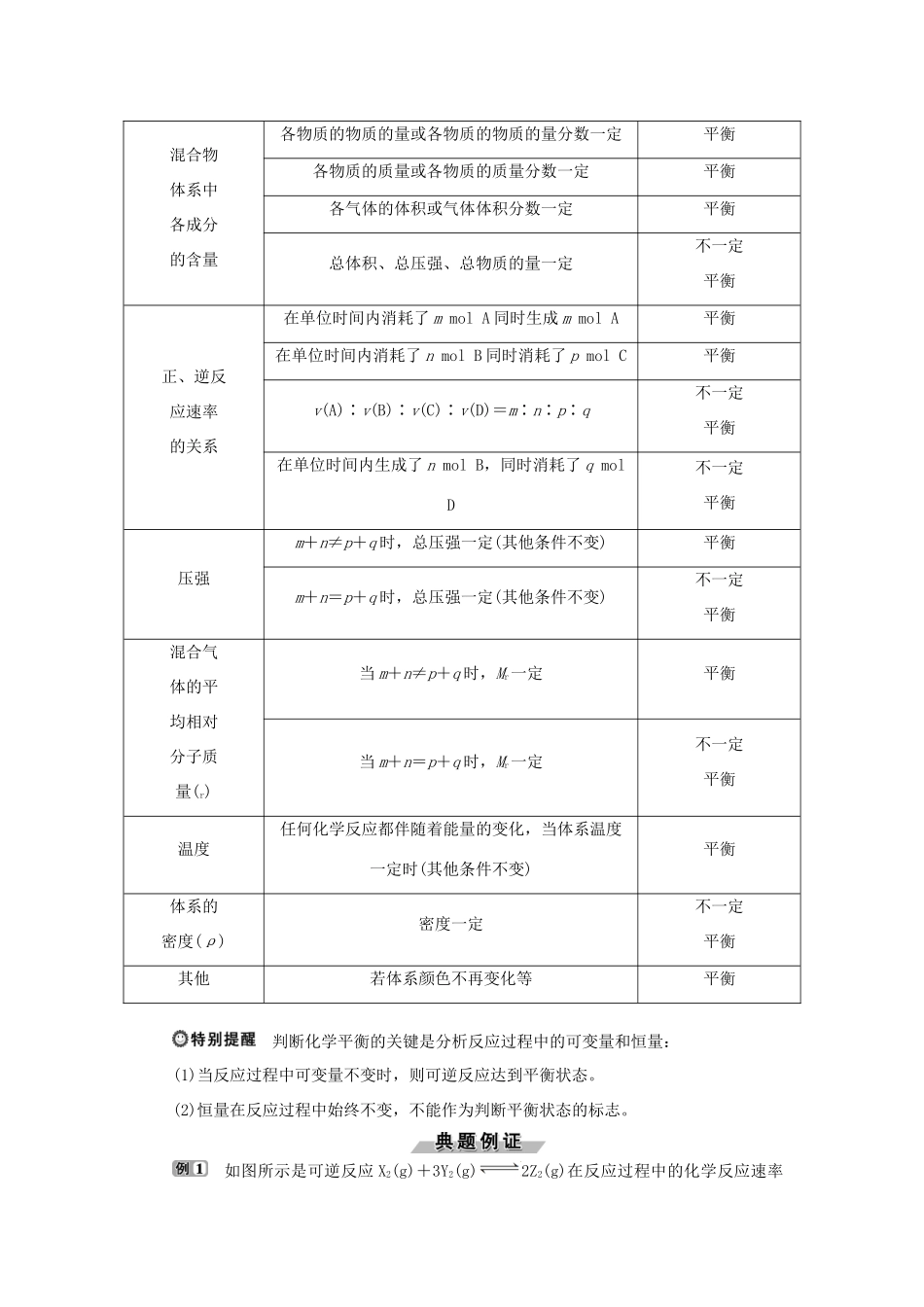
第2课时化学反应的限度1.理解可逆反应的含义。2.了解化学平衡的特征,知道外界条件能够影响化学平衡状态。可逆反应和化学平衡状态[学生用书P33]1.可逆反应(1)概念:在相同条件下同时向正、反两个方向进行的化学反应称为可逆反应。(2)特征①可逆反应在一定条件下不能进行到底,只能进行到一定程度,反应有一定限度,即达到平衡状态,此时各物质的量都大于零。②在可逆反应的化学方程式中,用“”代替“===”。2.化学平衡状态的建立(1)以反应2SO2+O2((((2SO3为例,在一定温度下,将0.02molSO2和0.01molO2通入1L密闭容器中,依据反应进行阶段填空。(2)在一定条件下的可逆反应中,正反应速率和逆反应速率随时间的变化如图所示。3.化学平衡状态(1)概念:在一定条件下可逆反应进行到一定程度时,反应物与生成物的浓度不再随时间的延长而发生变化,正反应速率与逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。(2)特征1.判断正误(1)NH3+HCl===NH4Cl和NH4Cl=====HCl↑+NH3↑为可逆反应。()(2)可逆反应达到最大限度状态也是反应停止状态。()(3)可以通过改变温度控制可逆反应的反应限度。()(4)可以通过延长时间增大可逆反应的反应限度。()(5)2SO2+O2((((2SO3反应中,v(SO2)∶v(O2)=2∶1时,反应达到平衡状态。()答案:(1)×(2)×(3)√(4)×(5)×2.在容器中充入SO2和只由18O组成的氧气(18O2)。在一定条件下达到平衡时,关于18O的说法正确的是()A.只存在于O2中B.只存在于O2和SO3中C.只存在于SO2和SO3中D.SO3、SO2和O2中都有可能存在解析:选D。可逆反应的特征是在同一条件下,正、逆反应同时进行,故18O在反应物和生成物分子中均可能存在。化学平衡状态的判断反应mA(g)+nB(g)pC(g)+qD(g)混合物体系中各成分的含量各物质的物质的量或各物质的物质的量分数一定平衡各物质的质量或各物质的质量分数一定平衡各气体的体积或气体体积分数一定平衡总体积、总压强、总物质的量一定不一定平衡正、逆反应速率的关系在单位时间内消耗了mmolA同时生成mmolA平衡在单位时间内消耗了nmolB同时消耗了pmolC平衡v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q不一定平衡在单位时间内生成了nmolB,同时消耗了qmolD不一定平衡压强m+n≠p+q时,总压强一定(其他条件不变)平衡m+n=p+q时,总压强一定(其他条件不变)不一定平衡混合气体的平均相对分子质量(r)当m+n≠p+q时,Mr一定平衡当m+n=p+q时,Mr一定不一定平衡温度任何化学反应都伴随着能量的变化,当体系温度一定时(其他条件不变)平衡体系的密度(ρ)密度一定不一定平衡其他若体系颜色不再变化等平衡判断化学平衡的关键是分析反应过程中的可变量和恒量:(1)当反应过程中可变量不变时,则可逆反应达到平衡状态。(2)恒量在反应过程中始终不变,不能作为判断平衡状态的标志。如图所示是可逆反应X2(g)+3Y2(g)2Z2(g)在反应过程中的化学反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()A.t1时,只有正方向反应在进行B.t1~t2,X2的物质的量越来越多C.t2~t3,反应已经停止D.t2~t3,各物质的浓度保持不变[解析]t1时正、逆反应都在进行,A错误;t1~t2,v(正)>v(逆),反应物X2和Y2的物质的量逐渐减少,B错误;t2~t3,反应达到平衡状态,v(正)=v(逆)≠0,各物质的浓度保持不变,C错误,D正确。[答案]D(1)上述例题中反应是哪一时刻达到化学平衡状态的?(2)上述例题中t2~t3,v正(X2)和v逆(Y2)存在什么关系?答案:(1)t2。(2)3v正(X2)=v逆(Y2)。可逆反应的判断及特点1.下列各组两个反应互为可逆反应的是()①H2+Cl2=====2HCl与2HCl=====H2↑+Cl2↑②H2SO4(浓)+2HBr===2H2O+Br2+SO2↑与Br2+SO2+2H2O===2HBr+H2SO4③2NO2===N2O4与N2O4===2NO2④2SO2+O2=====2SO3与2SO3=====2SO2+O2A.①②B.②③C.③④D.②④解析:选C。可逆反应必须是在相同条件下同时向正、逆两个方向都能进行的反应,③④互为可逆反应。2.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。关于此反应说法错误的是()A.一定属于吸热反应B.一定属于可逆反应C.一定属于氧化还原反应D.一定属于分解反应解析:选A。A....