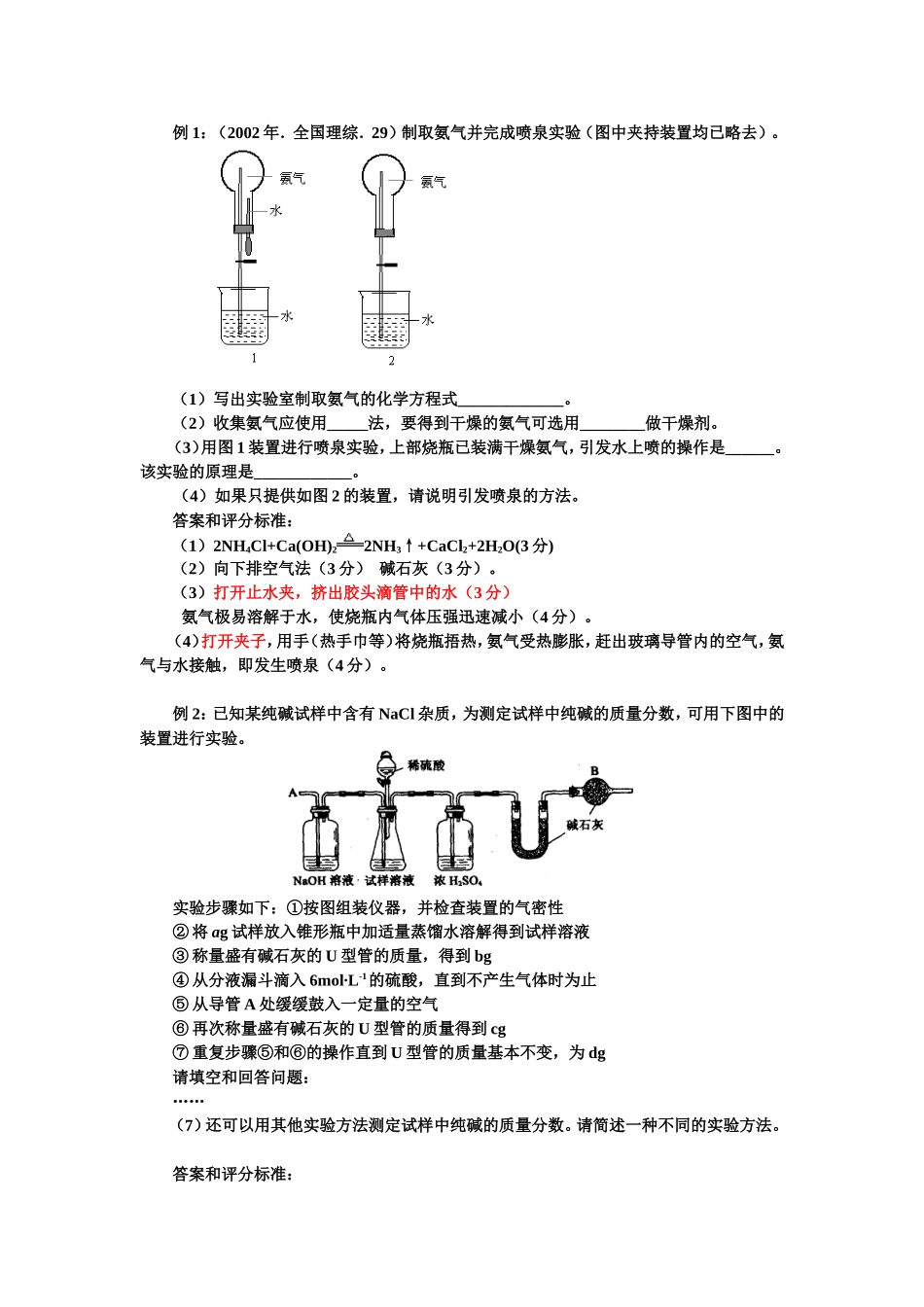
例1:(2002年.全国理综.29)制取氨气并完成喷泉实验(图中夹持装置均已略去)。(1)写出实验室制取氨气的化学方程式_____________。(2)收集氨气应使用_____法,要得到干燥的氨气可选用________做干燥剂。(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是______。该实验的原理是____________。(4)如果只提供如图2的装置,请说明引发喷泉的方法。答案和评分标准:(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(3分)(2)向下排空气法(3分)碱石灰(3分)。(3)打开止水夹,挤出胶头滴管中的水(3分)氨气极易溶解于水,使烧瓶内气体压强迅速减小(4分)。(4)打开夹子,用手(热手巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉(4分)。例2:已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。实验步骤如下:①按图组装仪器,并检查装置的气密性②将ag试样放入锥形瓶中加适量蒸馏水溶解得到试样溶液③称量盛有碱石灰的U型管的质量,得到bg④从分液漏斗滴入6mol∙L-1的硫酸,直到不产生气体时为止⑤从导管A处缓缓鼓入一定量的空气⑥再次称量盛有碱石灰的U型管的质量得到cg⑦重复步骤⑤和⑥的操作直到U型管的质量基本不变,为dg请填空和回答问题:……(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。答案和评分标准:(7)取样品加入足量的稀硝酸,再加入硝酸银溶液,滤出沉淀(沉淀是氯化银),干燥并称量。根据实验数据计算出杂质氯化钠的质量,再计算碳酸钠的纯度。(4分)