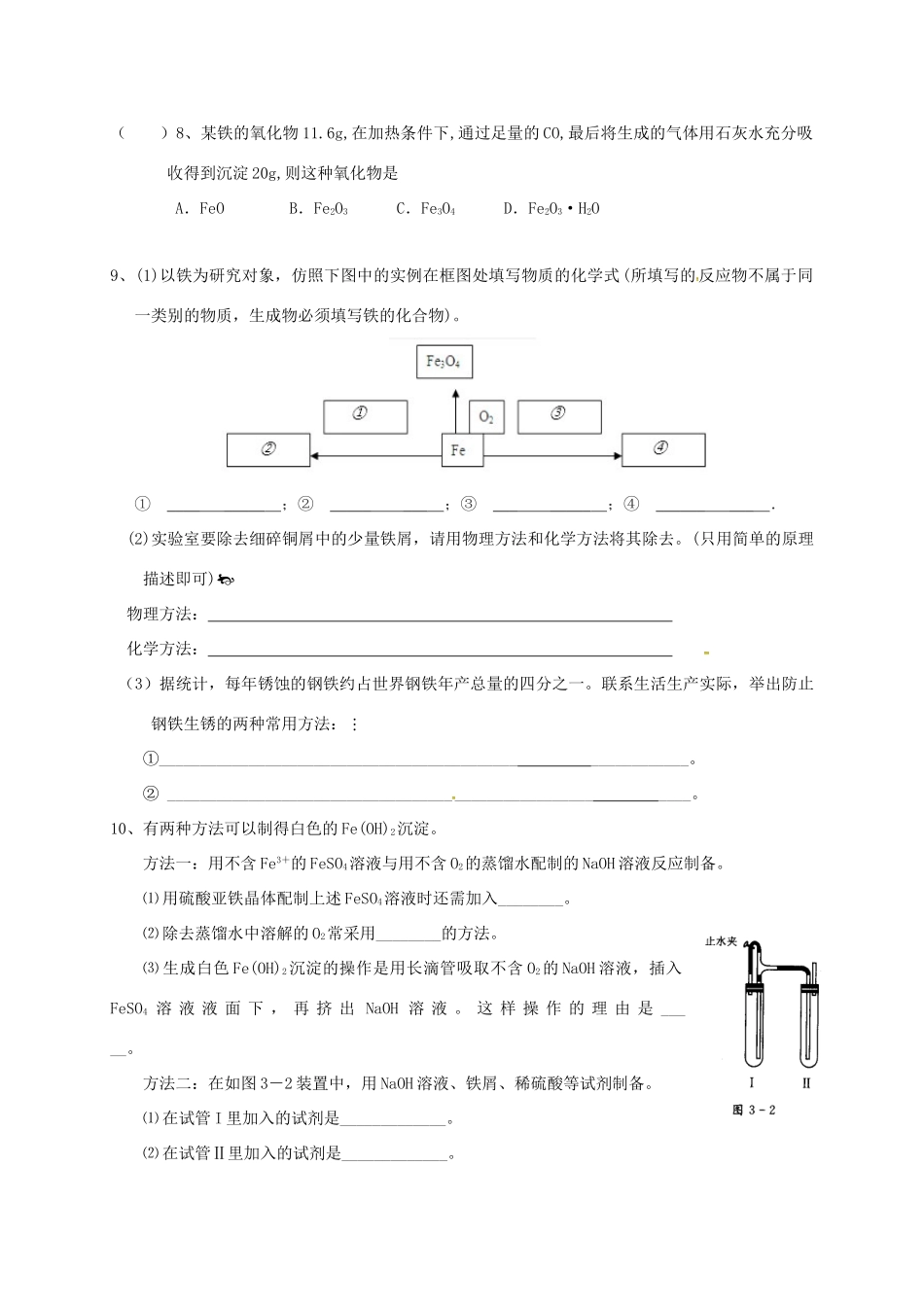
第二节几种重要的金属化合物练习四()1、下列叙述中正确的是A.含金属元素的离子一定都是阳离子B.酸性氧化物都可以与NaOH溶液反应C.金属的氢氧化物都可由金属氧化物与水反应得到D.金属氧化物都是碱性氧化物()2、在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是A.FeB.FeOC.Fe(OH)3D.Fe2O3()3、下列关于铁及其化合物的叙述正确的是A.在氢氧化钠中加入适量的氯化亚铁溶液,立即有红褐色沉淀产生B.将铁片投入稀HCl中,有气泡产生C.将铁片与水蒸气在高温条件下反应生成Fe2O3D.Fe2O3溶于酸反应生成Fe2+()4、只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是A.Ba(OH)2B.H2SO4C.NaOHD.AgNO3()5、鉴别①NaOH、②Al2(SO4)3、③Ba(NO3)2、④FeCl3、⑤KCl五种溶液,不用其它试剂,被鉴别出来的顺序是A.①②③④⑤B.④③①②⑤C.④①②③⑤D.②③①④⑤()6、某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,下列结论中正确的是A.一定有Fe2+,一定没有Fe3+、Mg2+B.一定有Fe3+存在,一定没有Fe2+、Mg2+C.一定有Fe3+,可能有Fe2+,一定没有Mg2+D.一定有Fe2+,可能有Mg2+,一定没有Fe3+()7、下列变化不能通过一步实验直接完成的是A.Fe→Fe3O4B.Fe(OH)3→Fe2O3C.Al→Al(OH)3D.Na2O2→Na2CO3()8、某铁的氧化物11.6g,在加热条件下,通过足量的CO,最后将生成的气体用石灰水充分吸收得到沉淀20g,则这种氧化物是A.FeOB.Fe2O3C.Fe3O4D.Fe2O3·H2O9、(1)以铁为研究对象,仿照下图中的实例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。①_________;②________;③________;④_________.(2)实验室要除去细碎铜屑中的少量铁屑,请用物理方法和化学方法将其除去。(只用简单的原理描述即可)物理方法:化学方法:(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:①________________________________________________________。②________________________________________________________。10、有两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。⑵除去蒸馏水中溶解的O2常采用________的方法。⑶生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____。方法二:在如图3-2装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。⑴在试管I里加入的试剂是_____________。⑵在试管Ⅱ里加入的试剂是_____________。⑶为了制得白色Fe(OH)2沉淀,在试管工和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_______。⑷这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________________________________________________。附加题:()1、将Na2O2投入FeCl2溶液中,可观察到的实验现象是(双选)A.有白色沉淀生成B.有红褐色沉淀生成C.没有沉淀生成D.有无色气体产生()2、某溶液中有NH4+、Mg2+、Al3+、Fe2+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸;溶液中大量减少的阳离子是(双选)A.NH4+B.Mg2+C.Fe2+D.Al3+3、3.84gFe和Fe2O3的混合物溶于过量盐酸中,生成0.03molH2,向反应后的溶液中加入KSCN(KSCN用于检验Fe3+),溶液无明显现象。求原混合物中Fe2O3的质量。