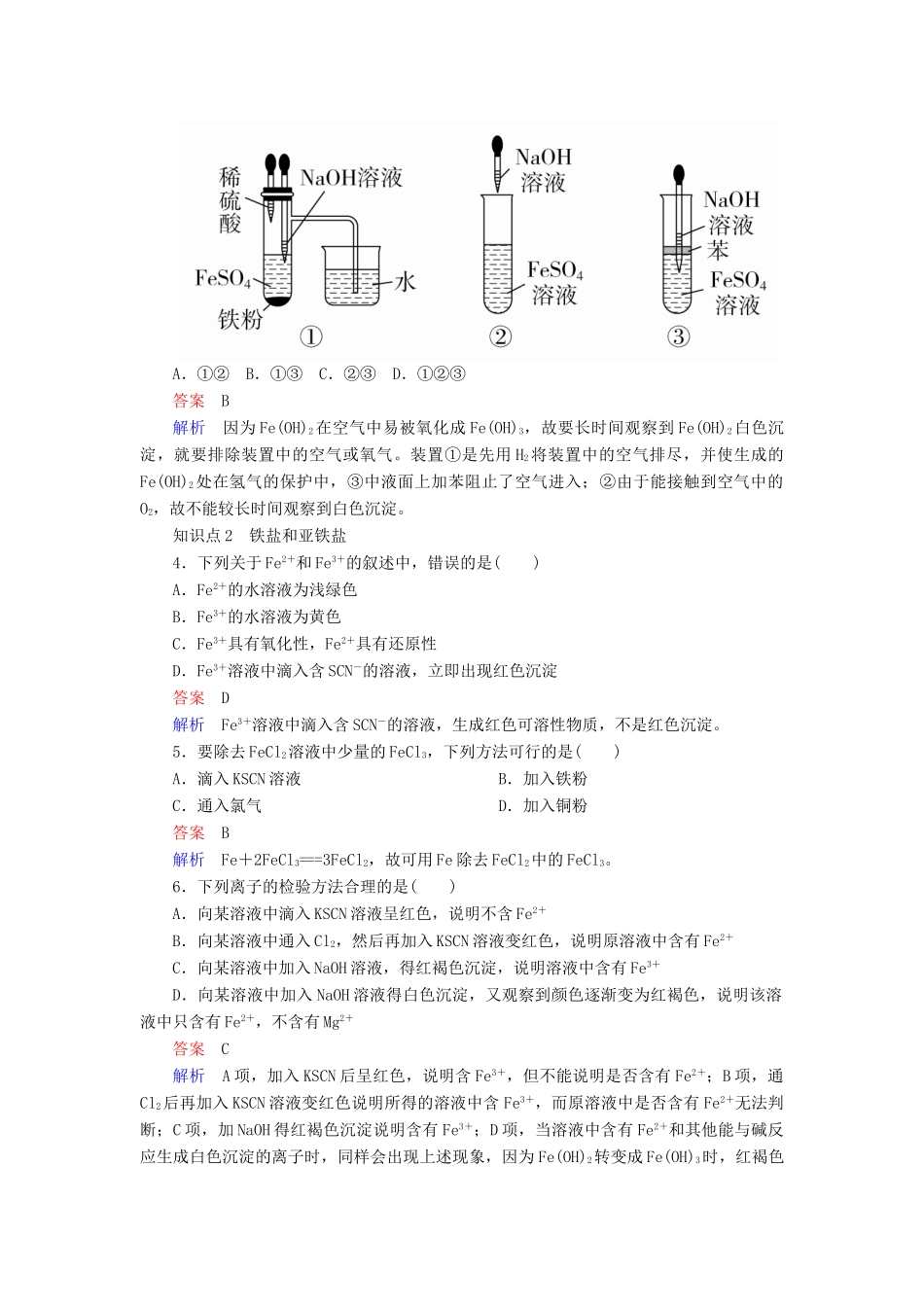
第二节几种重要的金属化合物第三课时铁的重要化合物[A篇知识对点训练]知识点1铁的氧化物和氢氧化物1.下列物质的颜色和性质或用途对应正确的是()A.①④⑤B.②③C.①②③④⑤D.①③答案D解析Fe(OH)2为白色;Fe2+具有较强的还原性,Fe3+具有较强的氧化性。2.下列说法正确的是()A.赤铁矿的主要成分是Fe3O4B.Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3C.铁锈的主要成分是Fe2O3D.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物答案C解析赤铁矿、铁锈的主要成分是Fe2O3,A错误,C正确;Fe2O3为碱性氧化物,但不与水反应,B错误;Fe3O4为纯净物,不是混合物,D错误。3.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是()A.①②B.①③C.②③D.①②③答案B解析因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中,③中液面上加苯阻止了空气进入;②由于能接触到空气中的O2,故不能较长时间观察到白色沉淀。知识点2铁盐和亚铁盐4.下列关于Fe2+和Fe3+的叙述中,错误的是()A.Fe2+的水溶液为浅绿色B.Fe3+的水溶液为黄色C.Fe3+具有氧化性,Fe2+具有还原性D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀答案D解析Fe3+溶液中滴入含SCN-的溶液,生成红色可溶性物质,不是红色沉淀。5.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是()A.滴入KSCN溶液B.加入铁粉C.通入氯气D.加入铜粉答案B解析Fe+2FeCl3===3FeCl2,故可用Fe除去FeCl2中的FeCl3。6.下列离子的检验方法合理的是()A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+答案C解析A项,加入KSCN后呈红色,说明含Fe3+,但不能说明是否含有Fe2+;B项,通Cl2后再加入KSCN溶液变红色说明所得的溶液中含Fe3+,而原溶液中是否含有Fe2+无法判断;C项,加NaOH得红褐色沉淀说明含有Fe3+;D项,当溶液中含有Fe2+和其他能与碱反应生成白色沉淀的离子时,同样会出现上述现象,因为Fe(OH)2转变成Fe(OH)3时,红褐色很容易掩盖其他白色沉淀的现象。7.选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂顺序能达到实验目的的是()答案B解析由于Fe3+的干扰,在检验Fe2+时使用酸性KMnO4溶液,只有B正确。8.已知下述三个实验均能发生化学反应:①②③将铁钉放入硫酸铜溶液中向硫酸亚铁溶液中滴入几滴氯水将铜丝放入氯化铁溶液中下列判断正确的是()A.实验①中铁钉只作还原剂B.实验②中Fe2+既显氧化性又显还原性C.实验③中发生的是置换反应D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+答案A解析实验①中铁钉作还原剂,氧化性Cu2+>Fe2+;实验②中Fe2+只表现还原性,实验③中反应为2FeCl3+Cu===2FeCl2+CuCl2,不是置换反应,分析可知:氧化性:Fe3+>Cu2+,综上可知氧化性Fe3+>Cu2+>Fe2+,故A正确,B、C、D错误。[B篇综合提升训练]9.下列关于铁及其化合物的说法中正确的是()A.Fe3O4是一种红棕色粉末,俗称磁性氧化铁B.铁与水蒸气在高温下的反应产物为Fe2O3和H2C.去除FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤D.Fe2+与KSCN反应产生红色溶液答案C解析A项,Fe3O4是一种黑色晶体,俗称磁性氧化铁;B项,铁与水蒸气在高温下的反应产物为Fe3O4和H2;D项,Fe3+与KSCN反应产生红色溶液。10.把铁和铜加入氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余,则()A.溶液中有Fe2+、Cu2+B.剩下的固体是Fe和CuC.溶液中有Fe3+、Fe2+D.剩下的固体是Fe,无Cu答案B解析铁粉能发生反应:Fe+2Fe3+===3Fe2+,Fe+Cu2+===Cu+Fe2+,若铁粉过量,则溶液中一定无Fe3+(以Fe2+形式存在),无Cu2+(以Cu形式存在)。11.向一定...