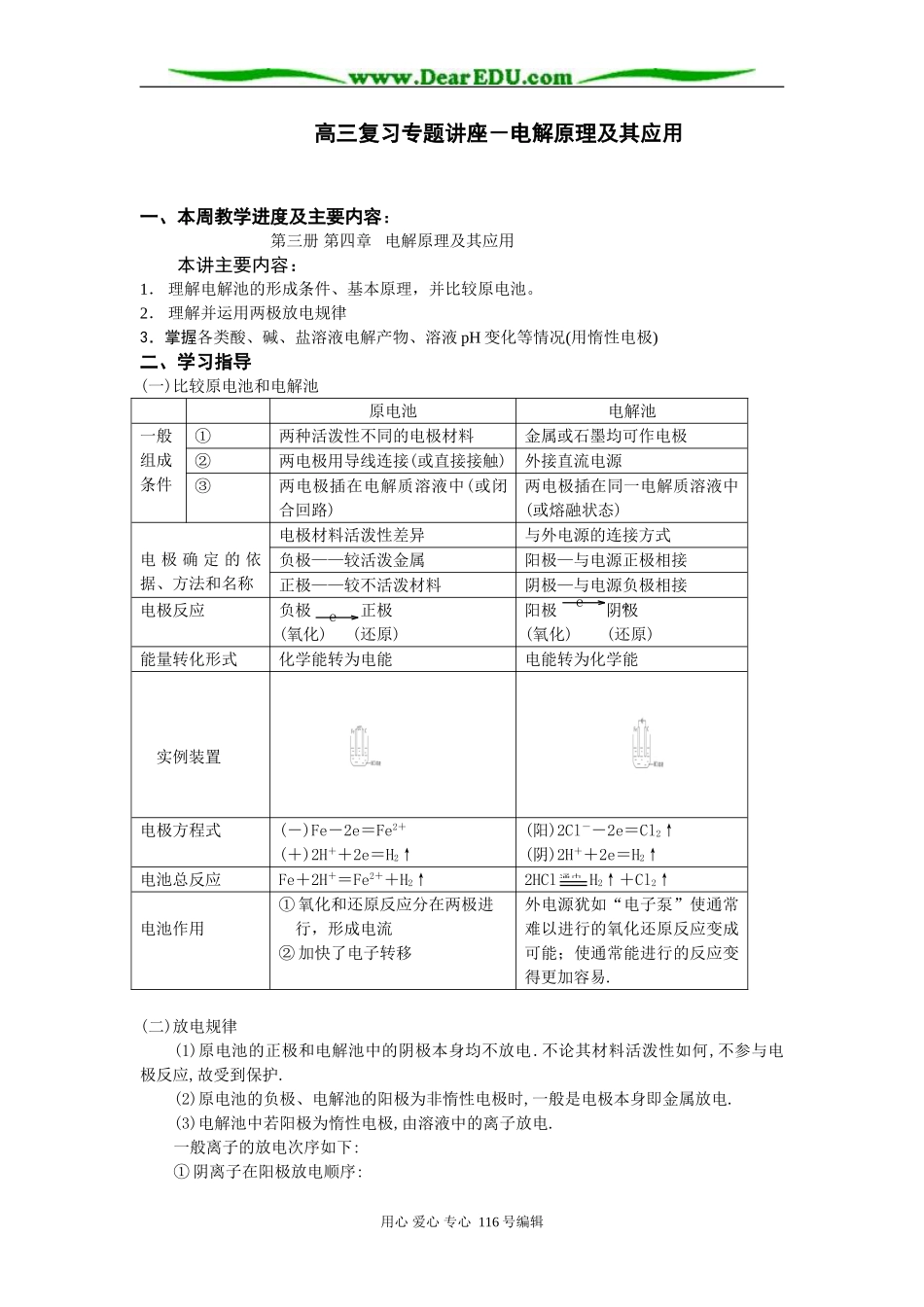
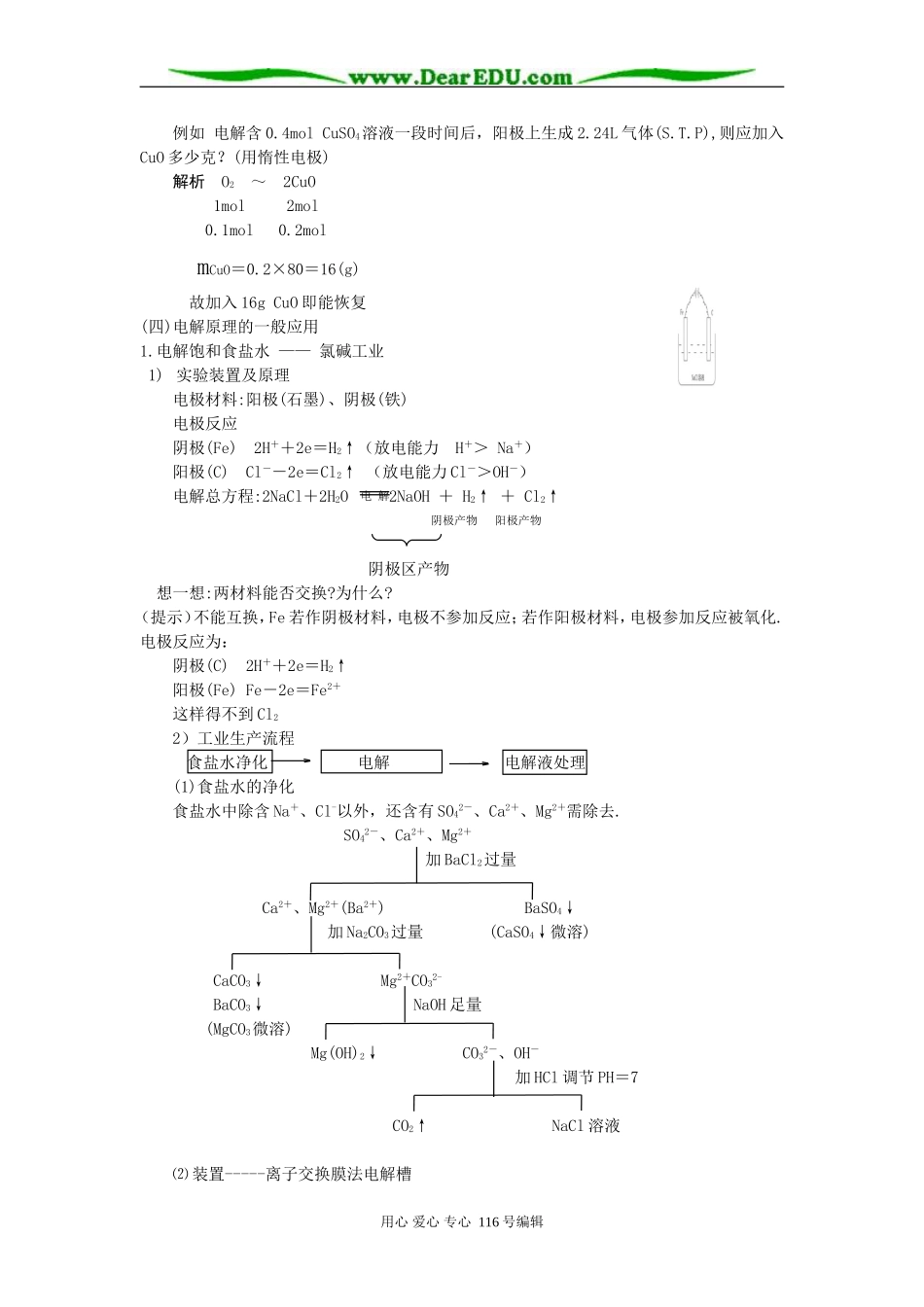
高三复习专题讲座-电解原理及其应用一、本周教学进度及主要内容:第三册第四章电解原理及其应用本讲主要内容:1.理解电解池的形成条件、基本原理,并比较原电池。2.理解并运用两极放电规律3.掌握各类酸、碱、盐溶液电解产物、溶液pH变化等情况(用惰性电极)二、学习指导(一)比较原电池和电解池原电池电解池一般组成条件①两种活泼性不同的电极材料金属或石墨均可作电极②两电极用导线连接(或直接接触)外接直流电源③两电极插在电解质溶液中(或闭合回路)两电极插在同一电解质溶液中(或熔融状态)电极确定的依据、方法和名称电极材料活泼性差异与外电源的连接方式负极——较活泼金属阳极—与电源正极相接正极——较不活泼材料阴极—与电源负极相接电极反应负极正极(氧化)(还原)阳极阴极(氧化)(还原)能量转化形式化学能转为电能电能转为化学能实例装置电极方程式(-)Fe-2e=Fe2+(+)2H++2e=H2↑(阳)2Cl--2e=Cl2↑(阴)2H++2e=H2↑电池总反应Fe+2H+=Fe2++H2↑2HClH2↑+Cl2↑电池作用①氧化和还原反应分在两极进行,形成电流②加快了电子转移外电源犹如“电子泵”使通常难以进行的氧化还原反应变成可能;使通常能进行的反应变得更加容易.(二)放电规律(1)原电池的正极和电解池中的阴极本身均不放电.不论其材料活泼性如何,不参与电极反应,故受到保护.(2)原电池的负极、电解池的阳极为非惰性电极时,一般是电极本身即金属放电.(3)电解池中若阳极为惰性电极,由溶液中的离子放电.一般离子的放电次序如下:①阴离子在阳极放电顺序:用心爱心专心116号编辑通电eeeSO42-、NO3-、OH-、Cl-、Br-、I-、S2-失电子能力依次增强②阳离子在阴极放电顺序K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、H+、Cu2+、Ag+得电子能力依次增强(三)各类酸、碱、盐溶液电解产物、溶液pH变化等情况小结(用惰性电极)电解液(实例)电极产物相当于电解何物pH值变化为恢复可加入的物质阳极阴极含氧酸(H2SO4)O2H2H2O减小H2O可溶性强碱(NaOH)O2H2增大活泼金属含氧酸盐(Na2SO4)O2H2由盐种类定无氧酸(HCl)Cl2H2电解质本身增大HCl不活泼金属无氧酸盐(CuCl2)Cl2Cu/CuCl2活泼金属无氧酸盐(NaCl)Cl2H2水和电解质增大HCl不活泼金属含氧酸盐(CuSO4)O2Cu减小CuO思考1:电解一段时间,为了恢原到电解前的溶液,如何确定所加入物质的种类?(惰性电极)分析随着电解的进行,电解液或是浓度改变,或是溶质的种类改变,或是两者均有变化.为了恢复到原溶液,既要考虑“质”又要考虑“量”.例如:电解CuSO4溶液:2H2O+2CuSO42Cu+O2↑+2H2SO4思路一抓住溶液的变化若加入CuO、Cu(OH)2,均能与H2SO4反应生成CuSO4.方程式如下:①CuO+H2SO4=CuSO4+H2O②Cu(OH)2+H2SO4=CuSO4+2H2O比较①、②消耗的H2SO4、生成的CuSO4、H2O即可知道:加入1molCu(OH)2能与1molH2SO4反应能生成1molCuSO4和2H2O.不符合电解时的相关物质的比例.若改加CuO,则很合适.思路二抓住两极产物.“合二为一”.原理电解时电解质溶液减少的质量即为两极上产物的质量和,符合守恒原理,但直接通入或加入所得的产物,可能有的根本不反应,即使有的反应又有其它产物,如电解食盐水,若再通入H2和Cl2,则Cl2与NaOH反应生成NaCl和NaClO,H2与NaOH根本不反应。何况一般只允许加入一种物质。从守恒角度考虑,电解CuSO4溶液,阴极析出Cu,阳极生成O2,H元素的质量并未减少。因而当加入Cu(OH)2时,从元素种类的守恒考虑就不符合,更不必考虑量是否符合了.故可将两极产物中元素合为一种化合物.思考2如何确定所加物质的量?(惰性电极)分析由于两极上通过的电子数相等,故阴、阳两极产物的物质的量间一定满足确定的关系.因而加入物与其也有一定关系.用心爱心专心116号编辑电解例如电解含0.4molCuSO4溶液一段时间后,阳极上生成2.24L气体(S.T.P),则应加入CuO多少克?(用惰性电极)解析O2~2CuO1mol2mol0.1mol0.2molmCuO=0.2×80=16(g)故加入16gCuO即能恢复(四)电解原理的一般应用1.电解饱和食盐水——氯碱工业1)实验装置及原理电极材料:阳极(石墨)、阴极(铁)电极反应阴极(Fe)2H++2e=H2↑(放电能力H+>Na+)阳极(C)Cl--2e=Cl2↑(放电能力Cl->OH-)电解总方程:2NaC...