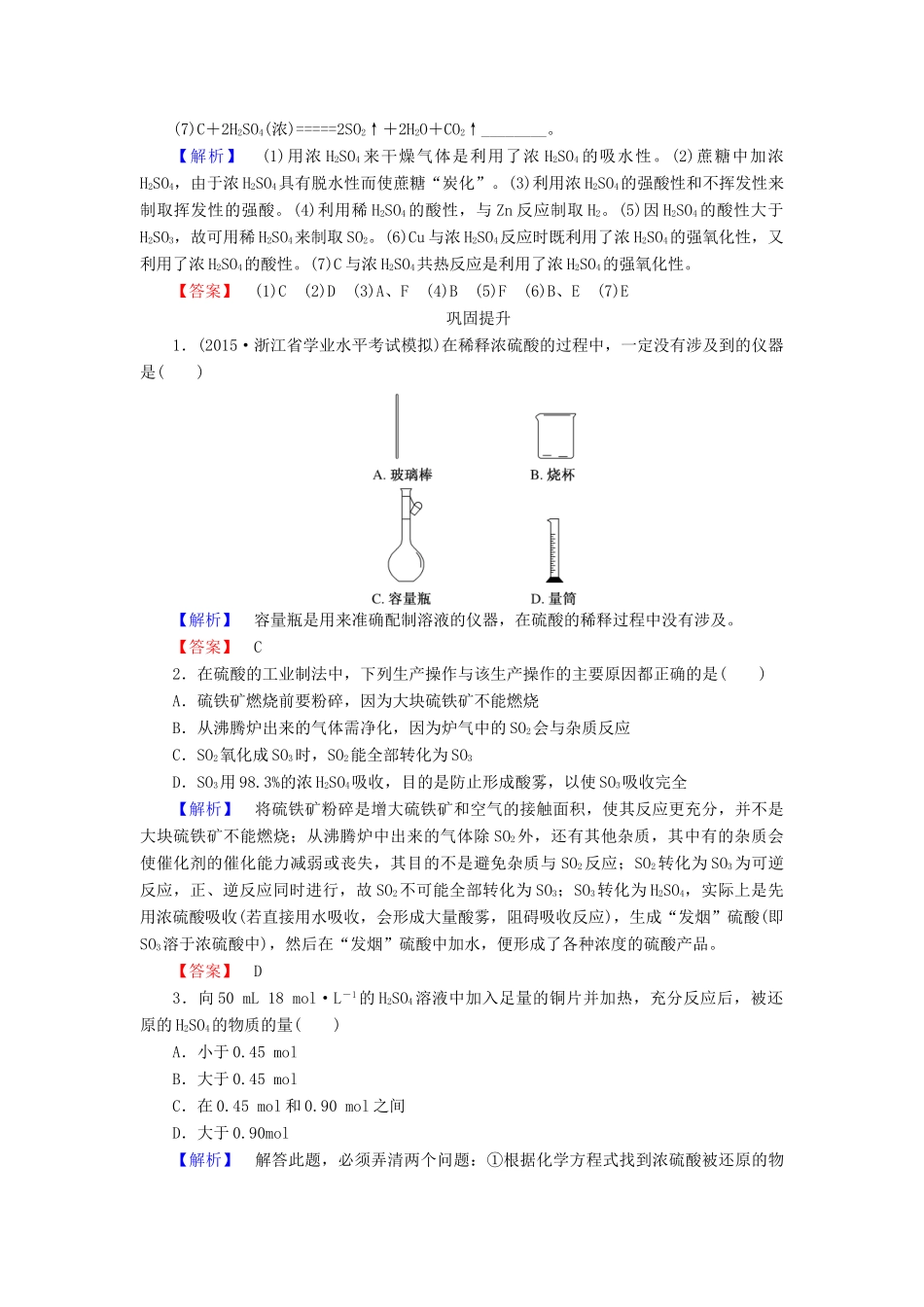
4.1.2《硫酸的工业制法》1.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入了大量瓷环。下列有关说法不正确的是()A.从①处通入SO3,整个吸收操作采取逆流的形式B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积C.从③处导出的气体只含有少量SO2,可直接排入大气D.从④处流出的是可用水或稀硫酸稀释的硫酸【解析】SO3的吸收通常使用98.3%的硫酸,不用水或稀硫酸,原因是用水或稀硫酸吸收SO3时容易形成酸雾,吸收速率慢,且不利于SO3的完全吸收。气体的吸收常采用逆流原理,这样有利于气、液的充分接触,吸收效果好。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。【答案】C2.工业制H2SO4的生产中,下列措施有利于提高SO2转化率的是()①V2O5作催化剂②通入O2过量③两次氧化④SO2、O2循环使用⑤通过热交换器进行热交换⑥通入过量SO2A.①②③B.②③④⑤C.②③④⑤⑥D.①②③④⑤⑥【解析】使用V2O5作催化剂只能提高化学反应速率,对SO2的转化率没有影响;通入过量的SO2不但不能提高转化率,反而转化率降低了。【答案】B3.填写下表步骤装置反应原理SO2的生成SO2的氧化SO3的吸收【答案】沸腾炉4FeS2+11O2=====8SO2+2Fe2O3接触室2SO2+O22SO3吸收塔SO3+H2O===H2SO4知识点2硫酸的性质4.向盐酸中加入浓H2SO4时,会有白雾生成,不是导致产生该现象的原因的是()A.浓H2SO4具有脱水性B.浓H2SO4具有吸水性C.盐酸具有挥发性D.气态溶质的溶解度随温度的升高而降低【解析】浓硫酸具有吸水性且溶于水放热,加快了盐酸的挥发。【答案】A5.(双选)下列反应中,浓硫酸既表现强氧化性,又表现酸性的是()A.2NaCl(固体)+H2SO4(浓)=====Na2SO4+2HCl↑B.C+2H2SO4(浓)=====CO2↑+2SO2↑+2H2OC.Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2OD.2FeO+4H2SO4(浓)===Fe2(SO4)3+SO2↑+4H2O【解析】A项体现的是浓硫酸的高沸点酸的性质;B项体现了浓硫酸的强氧化性;C、D项体现了浓硫酸的强氧化性和酸性。【答案】CD6.下列离子方程式中,不正确的是()A.氢氧化铜与硫酸反应Cu(OH)2+2H+===Cu2++2H2OB.铁与稀硫酸反应2Fe+6H+===2Fe3++3H2↑C.氯化钡溶液与硫酸反应Ba2++SO===BaSO4↓D.氧化铜与硫酸反应CuO+2H+===Cu2++H2O【答案】B7.蘸有浓H2SO4的纸片或火柴梗会变黑,主要是由于浓硫酸具有()A.吸水性B.脱水性C.强氧化性D.强酸性【解析】纸片或火柴梗是由C、H、O三种元素组成的,由于浓H2SO4具有脱水性,会使其中的H和O以H2O的形式脱去,从而剩下C,因此显黑色。【答案】B8.根据下列化学反应和事实,说明反应利用了硫酸的什么性质,将表示性质的选项的字母填在各小题的横线上。A.不挥发性B.酸性C.吸水性D.脱水性E.强氧化性F.强酸性(1)浓硫酸可作气体干燥剂________;(2)蔗糖中加浓H2SO4产生“黑面包”现象________;(3)2NaCl+H2SO4(浓)=====Na2SO4+2HCl↑________;(4)Zn+H2SO4(稀)===ZnSO4+H2↑________;(5)Na2SO3+H2SO4(稀)===Na2SO4+SO2↑+H2O________;(6)Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2O________________;(7)C+2H2SO4(浓)=====2SO2↑+2H2O+CO2↑________。【解析】(1)用浓H2SO4来干燥气体是利用了浓H2SO4的吸水性。(2)蔗糖中加浓H2SO4,由于浓H2SO4具有脱水性而使蔗糖“炭化”。(3)利用浓H2SO4的强酸性和不挥发性来制取挥发性的强酸。(4)利用稀H2SO4的酸性,与Zn反应制取H2。(5)因H2SO4的酸性大于H2SO3,故可用稀H2SO4来制取SO2。(6)Cu与浓H2SO4反应时既利用了浓H2SO4的强氧化性,又利用了浓H2SO4的酸性。(7)C与浓H2SO4共热反应是利用了浓H2SO4的强氧化性。【答案】(1)C(2)D(3)A、F(4)B(5)F(6)B、E(7)E巩固提升1.(2015·浙江省学业水平考试模拟)在稀释浓硫酸的过程中,一定没有涉及到的仪器是()【解析】容量瓶是用来准确配制溶液的仪器,在硫酸的稀释过程中没有涉及。【答案】C2.在硫酸的工业制法中,下列生产操作与该生产操作的主要原因都正确的是()A.硫铁矿燃烧前要粉碎,因为大块硫铁矿不能燃烧B.从沸腾炉出来的气体需净...