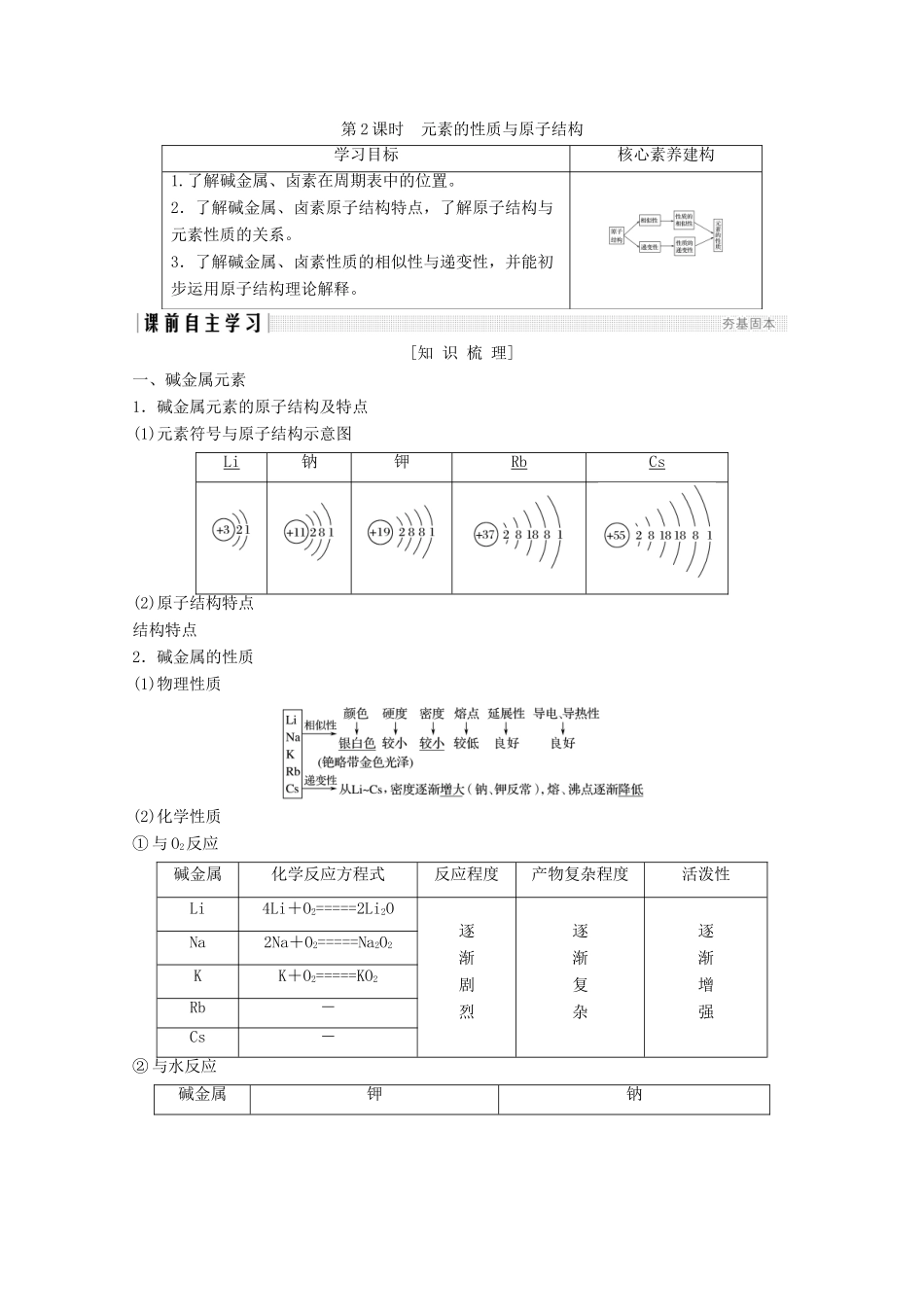
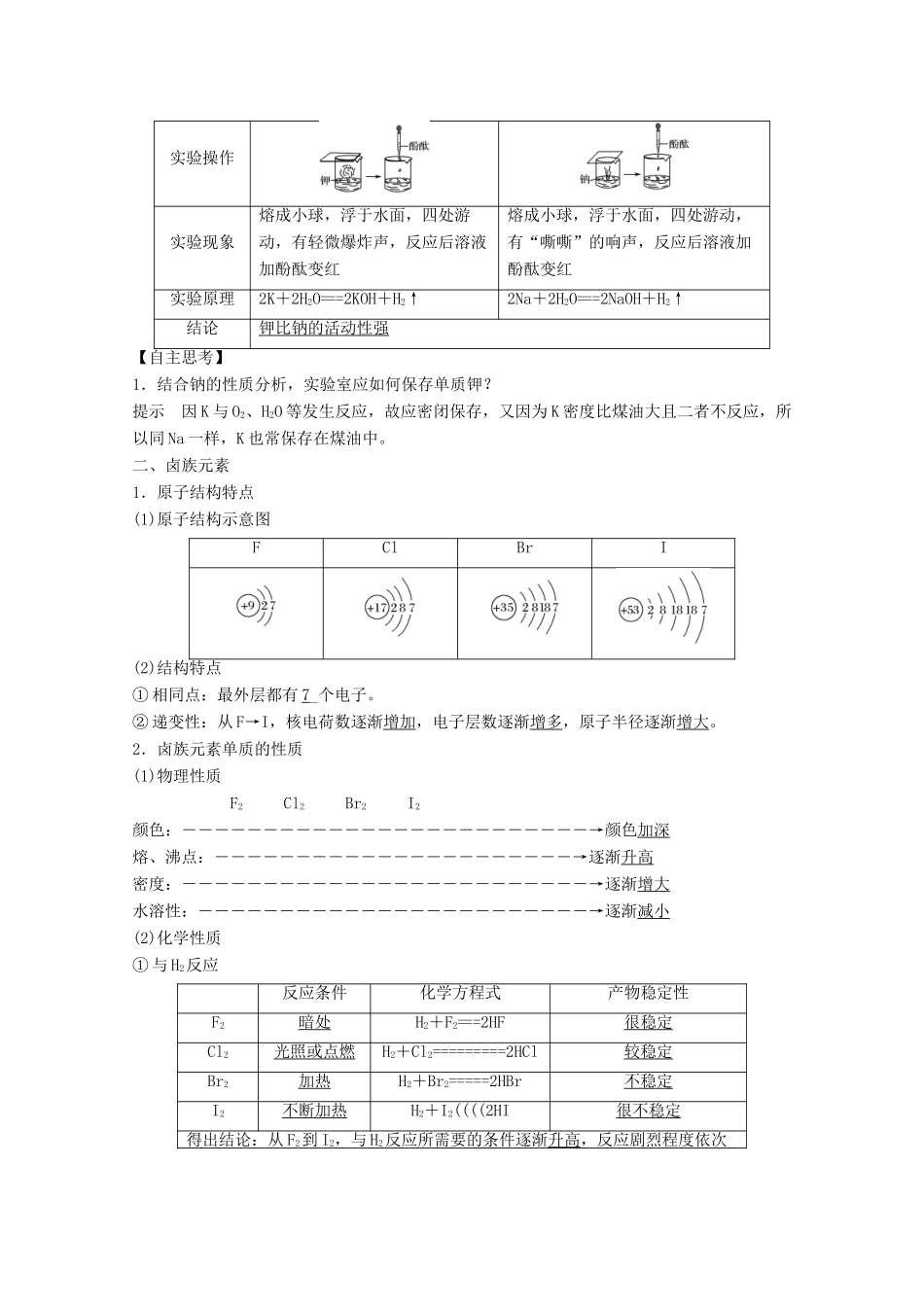
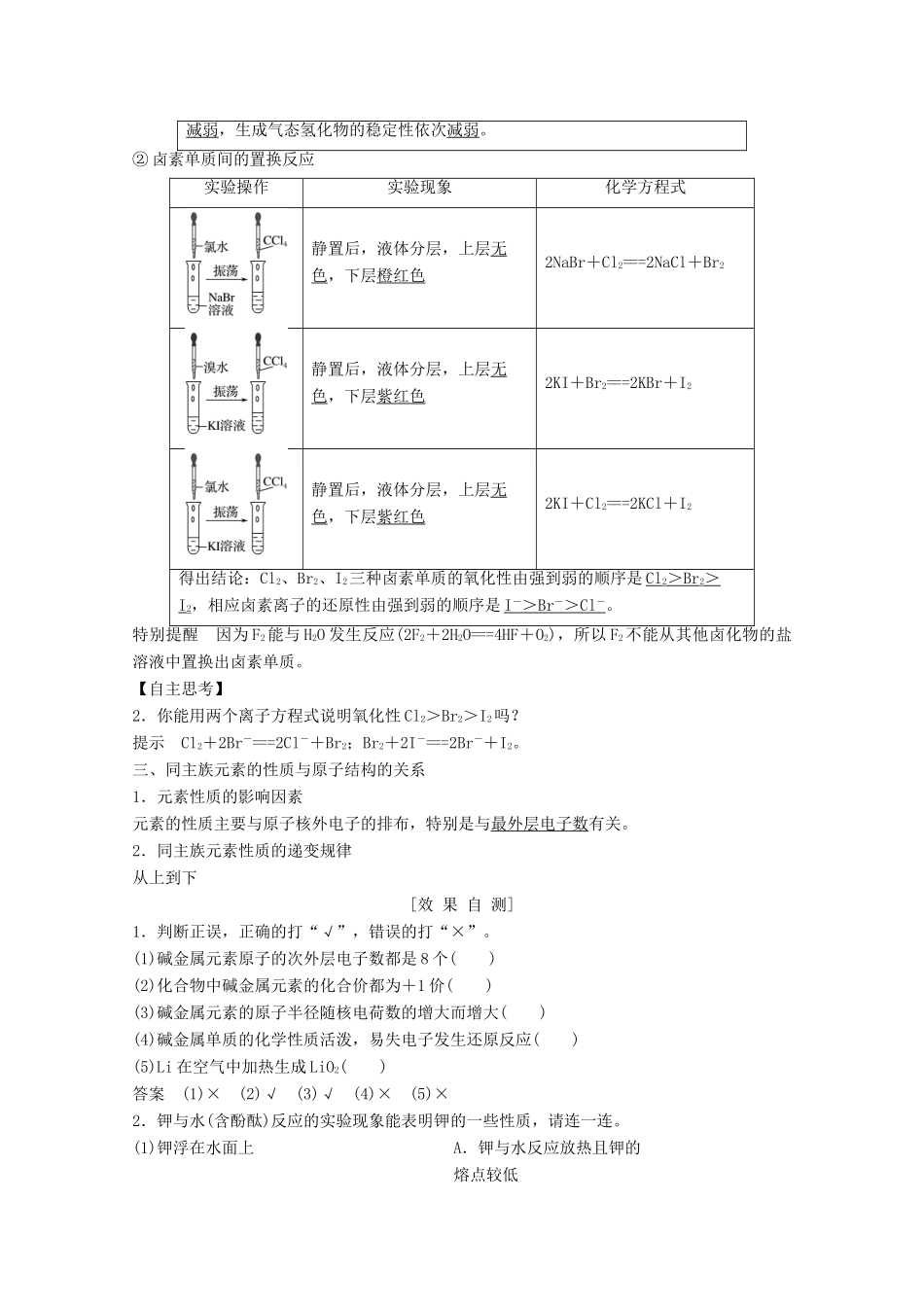
第2课时元素的性质与原子结构学习目标核心素养建构1.了解碱金属、卤素在周期表中的位置。2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。[知识梳理]一、碱金属元素1.碱金属元素的原子结构及特点(1)元素符号与原子结构示意图Li钠钾RbCs(2)原子结构特点结构特点2.碱金属的性质(1)物理性质(2)化学性质①与O2反应碱金属化学反应方程式反应程度产物复杂程度活泼性Li4Li+O2=====2Li2O逐渐剧烈逐渐复杂逐渐增强Na2Na+O2=====Na2O2KK+O2=====KO2Rb-Cs-②与水反应碱金属钾钠实验操作实验现象熔成小球,浮于水面,四处游动,有轻微爆炸声,反应后溶液加酚酞变红熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红实验原理2K+2H2O===2KOH+H2↑2Na+2H2O===2NaOH+H2↑结论钾比钠的活动性强【自主思考】1.结合钠的性质分析,实验室应如何保存单质钾?提示因K与O2、H2O等发生反应,故应密闭保存,又因为K密度比煤油大且二者不反应,所以同Na一样,K也常保存在煤油中。二、卤族元素1.原子结构特点(1)原子结构示意图FClBrI(2)结构特点①相同点:最外层都有7_个电子。②递变性:从F→I,核电荷数逐渐增加,电子层数逐渐增多,原子半径逐渐增大。2.卤族元素单质的性质(1)物理性质F2Cl2Br2I2颜色:―――――――――――――――――――――――――→颜色加深熔、沸点:――――――――――――――――――――――→逐渐升高密度:―――――――――――――――――――――――――→逐渐增大水溶性:――――――――――――――――――――――――→逐渐减小(2)化学性质①与H2反应反应条件化学方程式产物稳定性F2暗处H2+F2===2HF很稳定Cl2光照或点燃H2+Cl2=========2HCl较稳定Br2加热H2+Br2=====2HBr不稳定I2不断加热H2+I2((((2HI很不稳定得出结论:从F2到I2,与H2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。②卤素单质间的置换反应实验操作实验现象化学方程式静置后,液体分层,上层无色,下层橙红色2NaBr+Cl2===2NaCl+Br2静置后,液体分层,上层无色,下层紫红色2KI+Br2===2KBr+I2静置后,液体分层,上层无色,下层紫红色2KI+Cl2===2KCl+I2得出结论:Cl2、Br2、I2三种卤素单质的氧化性由强到弱的顺序是Cl2>Br2>I2,相应卤素离子的还原性由强到弱的顺序是I->Br->Cl-。特别提醒因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。【自主思考】2.你能用两个离子方程式说明氧化性Cl2>Br2>I2吗?提示Cl2+2Br-===2Cl-+Br2;Br2+2I-===2Br-+I2。三、同主族元素的性质与原子结构的关系1.元素性质的影响因素元素的性质主要与原子核外电子的排布,特别是与最外层电子数有关。2.同主族元素性质的递变规律从上到下[效果自测]1.判断正误,正确的打“√”,错误的打“×”。(1)碱金属元素原子的次外层电子数都是8个()(2)化合物中碱金属元素的化合价都为+1价()(3)碱金属元素的原子半径随核电荷数的增大而增大()(4)碱金属单质的化学性质活泼,易失电子发生还原反应()(5)Li在空气中加热生成LiO2()答案(1)×(2)√(3)√(4)×(5)×2.钾与水(含酚酞)反应的实验现象能表明钾的一些性质,请连一连。(1)钾浮在水面上A.钾与水反应放热且钾的熔点较低(2)钾熔化成闪亮的小球B.钾与水反应剧烈,放出的热使生成的H2燃烧C.钾的密度比水小(4)溶液变为红色D.钾与水反应后的溶液呈碱性答案(1)—C(2)—A(3)—B(4)—D3.判断正误,正确的打“√”,错误的打“×”(X代表卤素)(1)卤素单质与水反应均可用:X2+H2O===HXO+HX表示()(2)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强()(3)卤素单质的颜色从F2―→I2按相对分子质量增大而加深()(4)将F2通入NaCl溶液中可置换出Cl2()解析(1)F2与H2O反应为2F2+2H2O===4HF+O2,不可用X2+H2O===HXO+HX表示。(2)HX的热稳定性随核电荷数的增加而减弱。(4)F2性质极活泼,遇盐溶液先和水反应,故不能将卤素从它的盐溶...