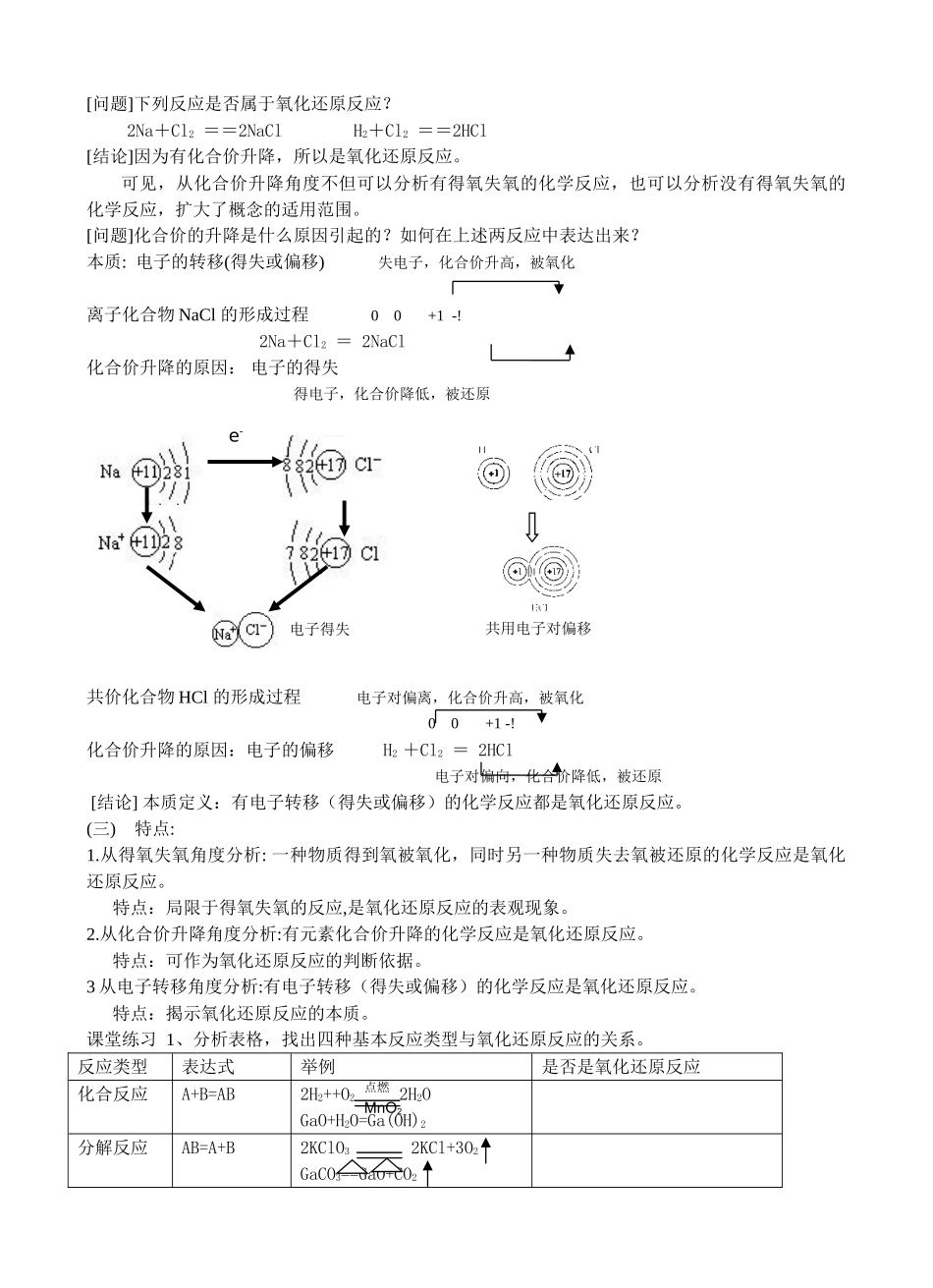
《氧化还原反应》教案知识与技能1、了解氧化还原反应与化合价升降的关系。2、理解氧化还原反应的本质及氧化还原反应与四种基本反应类型的关系过程与方法通过从不同角度对氧化还原反应的分析,学会科学探究的基本方法,提高科学探究能力。情感态度与价值观通过对氧化还原反应本质的学习,树立辩证唯物主义世界观,养成勇于创新、积极实践的科学态度。情境设疑易燃物的自然、食物的腐败、钢铁的冶炼及生锈、电解、电镀乃至人体生命过程中的新陈代谢等都涉及到一类重要的化学反应------氧化还原反应。你对氧化还原反应了解多少呢?引入新课复习:四种基本类型的反应反应类型表达式举例化合反应A+B=AB2H2++O22H2OGaO+H2O=Ga(OH)2分解反应AB=A+B2KClO32KCl+3O2GaCO3=GaO+CO2置换反应A+BC=AC+BZn+H2SO4=ZnSO4+H2Fe+CuSO4=FeSO4+Cu复分解反应AB+CD=AD+CBNaOH+HCl=NaCl+H2OBaCl2+CuSO4=BaSO4↓+CuCl2讨论:用四种基本类型的分类方法分析属于哪种类型的反应?教学内容一、氧化还原反应(一)概念:有一种物质发生氧化反应,同时有另一种物质发生还原反应的反应叫氧化还原反应。失去氧,被还原(还原反应)CuO+H2==Cu+H2O得到氧,被氧化(氧化反应)[问题]以上反应除了包含有得氧失氧的变化之外,还包含有什么变化?[结果]还包含有化合价的变化。(二)特征:有元素化合价的升降氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应化合价降低,被还原(还原反应)+200+1CuO+H2==Cu+H2O化合价升高,被氧化(氧化反应)[定义]有元素化合价升降的化学反应称为氧化还原反应。Fe2O3+3CO2Fe+3CO2高温点燃MnO2[问题]下列反应是否属于氧化还原反应?2Na+Cl2==2NaClH2+Cl2==2HCl[结论]因为有化合价升降,所以是氧化还原反应。可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。[问题]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?本质:电子的转移(得失或偏移)失电子,化合价升高,被氧化离子化合物NaCl的形成过程00+1-!2Na+Cl2=2NaCl化合价升降的原因:电子的得失得电子,化合价降低,被还原共价化合物HCl的形成过程电子对偏离,化合价升高,被氧化00+1-!化合价升降的原因:电子的偏移H2+Cl2=2HCl电子对偏向,化合价降低,被还原[结论]本质定义:有电子转移(得失或偏移)的化学反应都是氧化还原反应。(三)特点:1.从得氧失氧角度分析:一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。2.从化合价升降角度分析:有元素化合价升降的化学反应是氧化还原反应。特点:可作为氧化还原反应的判断依据。3从电子转移角度分析:有电子转移(得失或偏移)的化学反应是氧化还原反应。特点:揭示氧化还原反应的本质。课堂练习1、分析表格,找出四种基本反应类型与氧化还原反应的关系。反应类型表达式举例是否是氧化还原反应化合反应A+B=AB2H2++O22H2OGaO+H2O=Ga(OH)2分解反应AB=A+B2KClO32KCl+3O2GaCO3==GaO+CO2点燃MnO2共用电子对偏移e-电子得失置换反应A+BC=AC+BZn+H2SO4=ZnSO4+H2Fe+CuSO4=FeSO4+Cu复分解反应AB+CD=AD+CBNaOH+HCl=NaCl+H2OBaCl2+CuSO4=BaSO4↓+CuCl2[结论]置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。关系如下图:课堂练习2下列反应中属于氧化还原反应的是()ACaCO3+2HCl=CaCl2+CO2↑+H2OB.Na2O+H2O==2NaOHC.2KMnO4==K2MnO4+MnO2+O2↑D.MnO2+4HCl=MnCl2+2H2O+Cl2↑E.3Fe+2O2=Fe3O4F.CuSO4·5H2O==CuSO4+5H23、讨论:用四种基本类型的分类方法分析属于哪种类型的反应?布置作业Fe2O3+3CO2Fe+3CO2高温