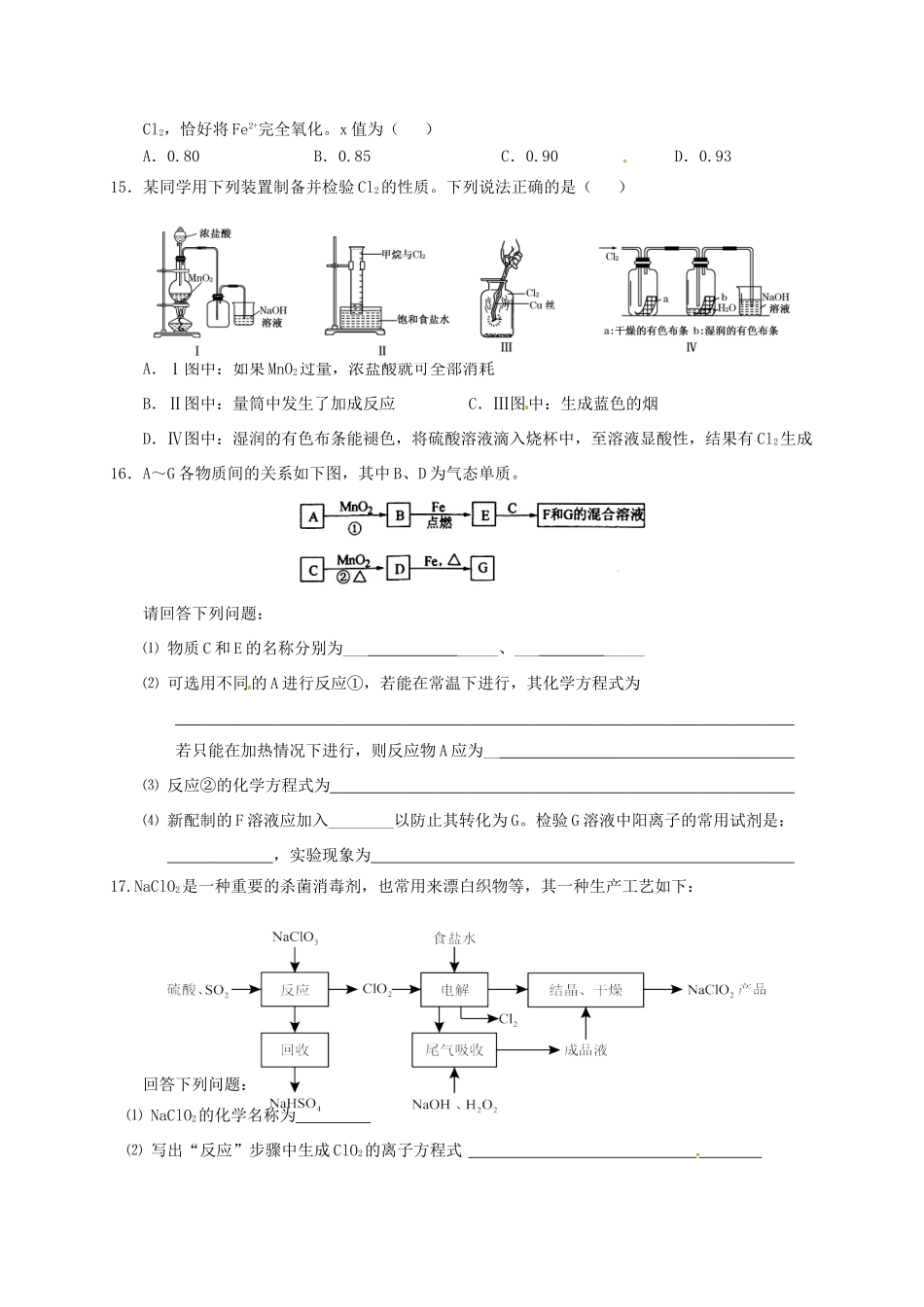
2016-2017学年高一第二学期期中考试化学试题注意事项:本试题分第I卷和第II卷两部分。试卷满分为100分。考试时间为90分钟。第一卷1.下列有关化学反应过程或实验现象的叙述中,正确的是()A.氯气的水溶液可以导电,说明氯气是电解质B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液具有酸性2.下列实验操作能达到实验目的的是()A.用长颈漏斗分离出乙酸与乙醇反应的产物B.用向上排空气法收集铜粉与稀硝酸反应产生的NOC.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl23.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()A.氯水的颜色呈浅绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO4.下列物质见光不会分解的是()A.HClOB.NH4ClC.HNO3D.AgNO35.放在敞口容器中的下列溶液,久置后溶液中溶质浓度会变大的是()A.浓硫酸B.氢氧化钠C.氯水D.氯化钠6.下列关于氯的说法正确的是()A.Cl2在化学反应中既能作氧化剂,又能作还原剂B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色C.Cl2通入到含有酚酞的NaOH溶液中,红色褪去,因为氯气有漂白性D.将SO2通入次氯酸钙溶液可生成次氯酸7.将0.2molMnO2和50mL12mol·L-1盐酸混合缓缓加热(不考虑HCl挥发),反应完全后余下的溶液中加入足量的AgNO3溶液,下列关于生成AgCl沉淀的物质的量的判断正确的是()A.等于0.3molB.小于0.3molC.大于0.3mol,小于0.6molD.以上结论都不正确8.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是()A.用装置甲制取氯气B.用装置乙除去氯气中的少量氯化氢C.用装置丙分离二氧化锰和氯化锰溶液D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O9.已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:aFe2++bBr-+cCl2→dFe3++eBr2+fCl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是()A.243226B.021012C.201202D.22221410.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲瓶中加入少量的NaHCO3晶体(amol),在乙瓶中加入少量的NaHSO3晶体(amol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是()(溶液体积变化不计)A.甲=乙>丙B.甲>丙>乙C.丙>甲=乙D.乙>丙>甲11.标准状况下H2和Cl2组成的混合气体2.24L,经点燃充分反应后,缓缓通入100mL1.2mol/LNaOH溶液中恰好完全反应,测得最终溶液中NaClO的浓度为0.2mol/L(假设溶液体积不变),则原混合气体中Cl2的体积分数(物质的量百分含量)为()A.55%B.60%C.65%D.70%12.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-、I-)离子。取甲液加入淀粉溶液和氯水溶液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙依次含有()A.Br-、Cl-、I-B.Br-、I-、Cl-C.I-、Br-、Cl-D.Cl-、I-、Br-13.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是()A.碳酸钙粉末B.稀硫酸C.氯化钙溶液D.二氧化硫水溶液14.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mLCl2,恰好将Fe2+完全氧化。x值为()A.0.80B.0.85C.0.90D.0.9315.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是()A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗B.Ⅱ图中:量筒中发生了加成反应C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成16.A~G各物质间的关系如下图,其中B、D为气态单质。请回答下列问题:⑴物质C和E的名称分别...