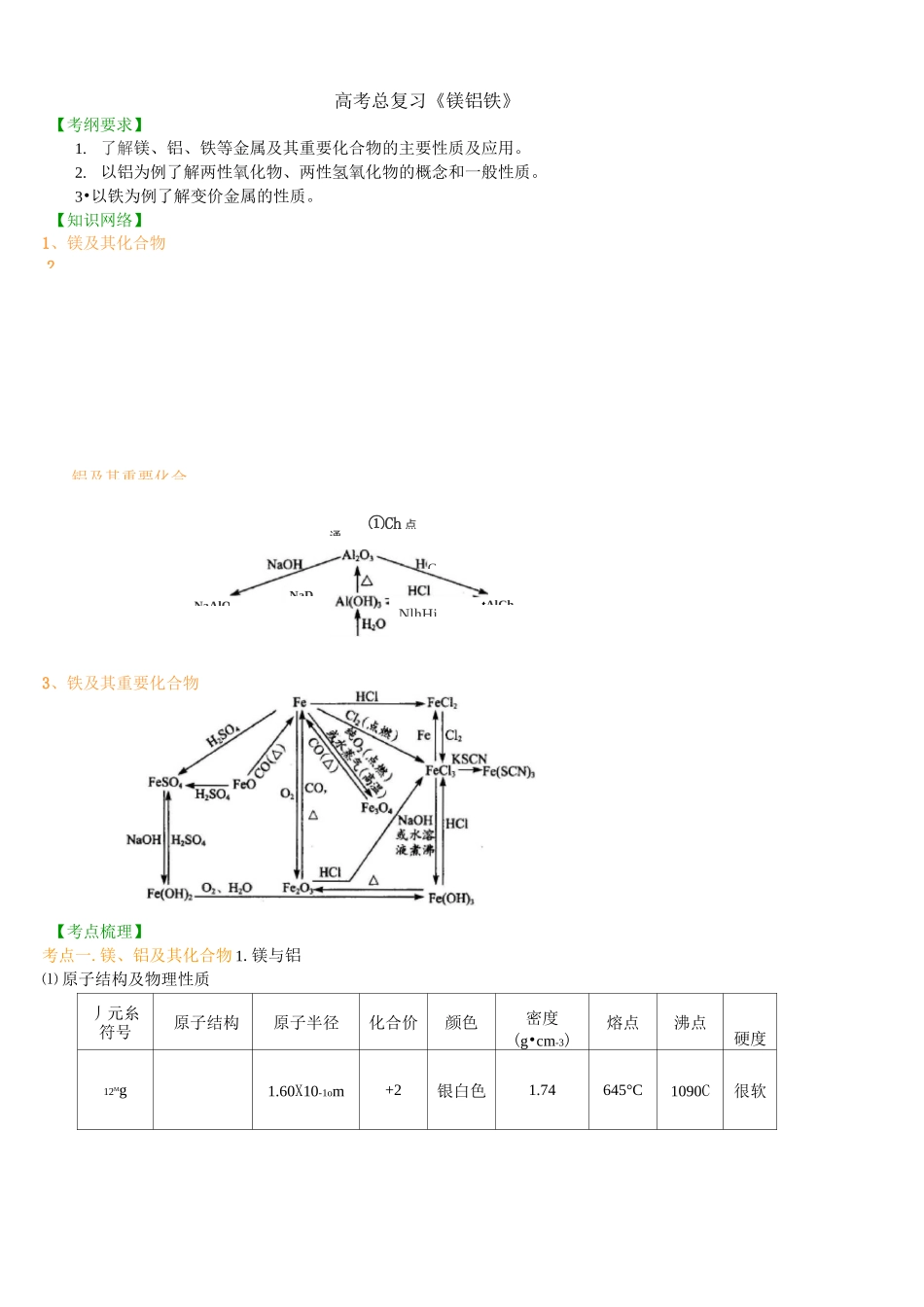
2、铝及其重要化合NaAlOj-高考总复习《镁铝铁》【考纲要求】1.了解镁、铝、铁等金属及其重要化合物的主要性质及应用。2.以铝为例了解两性氧化物、两性氢氧化物的概念和一般性质。3•以铁为例了解变价金属的性质。【知识网络】1、镁及其化合物3、铁及其重要化合物【考点梳理】考点一.镁、铝及其化合物1.镁与铝⑴原子结构及物理性质丿元糸符号原子结构原子半径化合价颜色密度(g•cm-3)熔点沸点硬度12Mg1.60X10-1om+2银白色1.74645°C1090C很软通CNaDNlhHj①Ch点tAlCh项MAO2方程点燃2Mg+O2MgO4A1+3O2亠=2Al2O3与非金属反应N2现剧烈反应、耀眼白光、放出大量Mg+2A1+33Mg+NMgsN与H2O方程现Mg+2H2OMg(OH)2+H2f冷水慢,[沸水快与酸反Mg+2H+=Mg2++H2f与溶2Al+6H2O(沸水)=2A1(OH)3+3H2f一般不反应,只有氧化膜被破坏后反与某些〈2Mg+C^点燃2MgO+C(白加黑)2Al+Fe2~2Fe+Al2O3主要用镁合13Al1.43X10-iom+3银白色2.70660.4°C2467°C较软要点诠释:①共同点:均为银白色,属于轻金属(P<4.5g/cm3),熔点较低,硬度较小。②不同点:密度:MgvAl,熔点:MgvAl,硬度:MgvAl。③原因:镁、铝均处于周期表的前半部,原子半径相对较大,而原子质量相对较小,故密度较小;原子半径大使得金属离子和自由电子间的结合力弱,故熔点和硬度较低,镁和铝相比较,原子半径镁比铝大,价电子数比铝少,故密度、熔点、硬度镁都比铝小。⑵镁铝的化学性质:较强的还原性:Mg>Al铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl2(熔融)墅i=Mg+Cl2f2Al2O3里1=4人1+302f2.镁和铝氧化物氧化物MgOAl2O3类属碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H2OMgO+H2O=Mg(OH)2;(反应缓慢进行)不溶解也不反应盐酸MgO+2H+=Mg2++H2OAl2O3+6H+=2A13++3H2ONaOH溶液不溶解也不反应Al2O3+2NaOH=2NaAlO2+H2O—FCl干燥气流中>MgCl―电解>Mg蒸发浓缩、冷却结晶、过流程加过量盐-Si。?Al203、Fe2O323:3铝土矿力口过量烧碱*A13+、Fe3+Mg2+、Cl-、H+Mg(OH)2»Fe(OH)3通入过量CO2一2MgO、SixNaAlO2、NaClNaOH2=NaCl、NaHCO3aA1(OH)3流程加过量烧_NaA1O2、Na2SiO3加过量盐酸NaOH*Fe2O3、MgO-H2SiO3.A1C13、NaClHC1过量氨水-A1(OH)3-NaCl、NH4C1NH3H2O重要用途制造耐火、耐高温材料制造耐火、耐咼温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3类属碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2壬三Mg2++2OH-H2O+AlO2+H+Al(OH)3Al3++3OH与HCl溶液Mg(OH)2+2HCl=MgCl2+2H2O(可溶于NH4Cl等强酸弱碱盐)Al(OH)3+3HCl=AlCl3+3H2O与NaOH溶液不反应Al(OH)3+NaOH=NaAlO2+2H2O热不稳定性Mg(OH)2MgO+H2O2Al(OH)3Al2O3+3H2O实验室制法可溶性镁盐加NaOH溶液Mg2++2OH-=Mg(OH)2;可溶性铝盐加氨水Al3++3NH3・H2O=Al(OH)3;+3NH4+4.镁铝的工业制取流程(1)以海水为原料提取镁:海水(或苦卤、光卤石溶液等)熟石灰>Mg(OH)2过滤>MgCl2溶液>MP96H.O2盐酸222要点诠释:①MgCl2的物理性质:易溶于水、味苦、易潮解,是制取镁的重要原料。②苦卤就是提取过食盐后的海水;光卤石成分为KCLMgCl2・6H2O。③海水的成分为:Na+、Mg2+、Cl-、Br-等。④MgCl2溶液变成MgCl2・6H2O的操作是:(2)以铝土矿为原料提取Al铝土矿主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质,提取Al的两种工艺流程如下:5.铝及其化合物间相互转化、铝三角及相关图象(1)铝三角氧化⑥向盐酸中滴(2)相关图象实验操作实验现象图象离子方程式①向A1C13溶液中滴先生成沉淀又溶A13++3OH-=A1(OH)3加NaOH溶液至过解A1(OH)3+OH=A1O2-+2H2O量1/.②向AlCl3溶液中滴加稀氨水至过量出现白色沉淀L234NaOH体积Al3++3NH3・H2O=A1(OH)3;+3NH4+③向NaOH溶液中滴加AlCl3溶液至过开始无明显变化,一段时间后出现[Z.■.1224HHj-HjO临也1(0屯的物质的塑厂Al3++4OH-=AlO2-+2H2O;3A1O2-+A13++6H2O=4A1(OH)3;量沉淀④向可溶性偏铝酸先沉淀又溶解「Ji2食4Aid.|AL(OH)j的物质的墜H++A1O2-+H2O=Al(OH)3;;盐溶液中滴加盐酸Al(OH)3+3H+=A13++3H2。AlO-2+2H2O+CO2(过量)=A1(OH)3;至过量⑤向NaAlO2溶液中先无明显变化,后123-dHCjf^积+.餉站庭rdt...