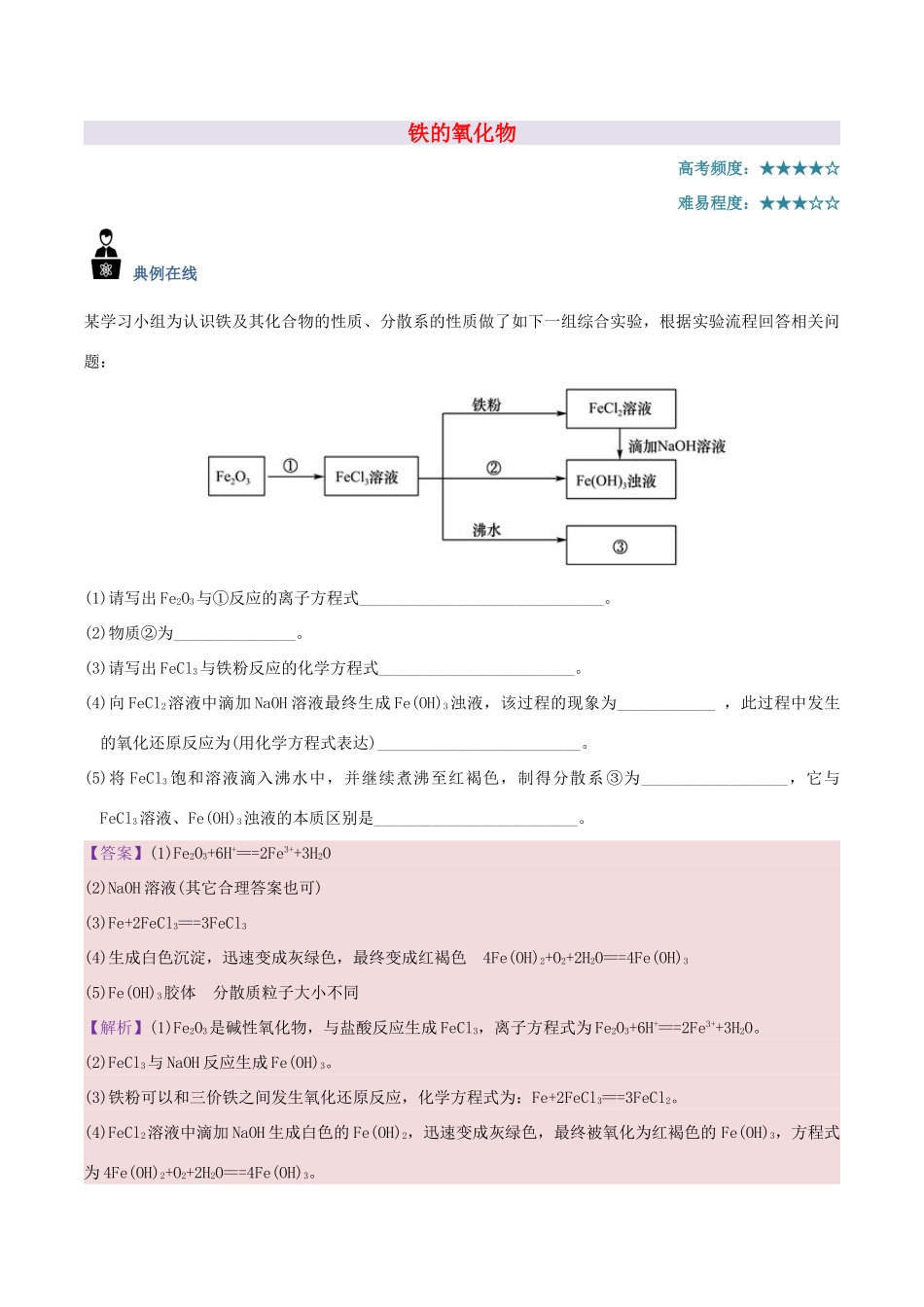
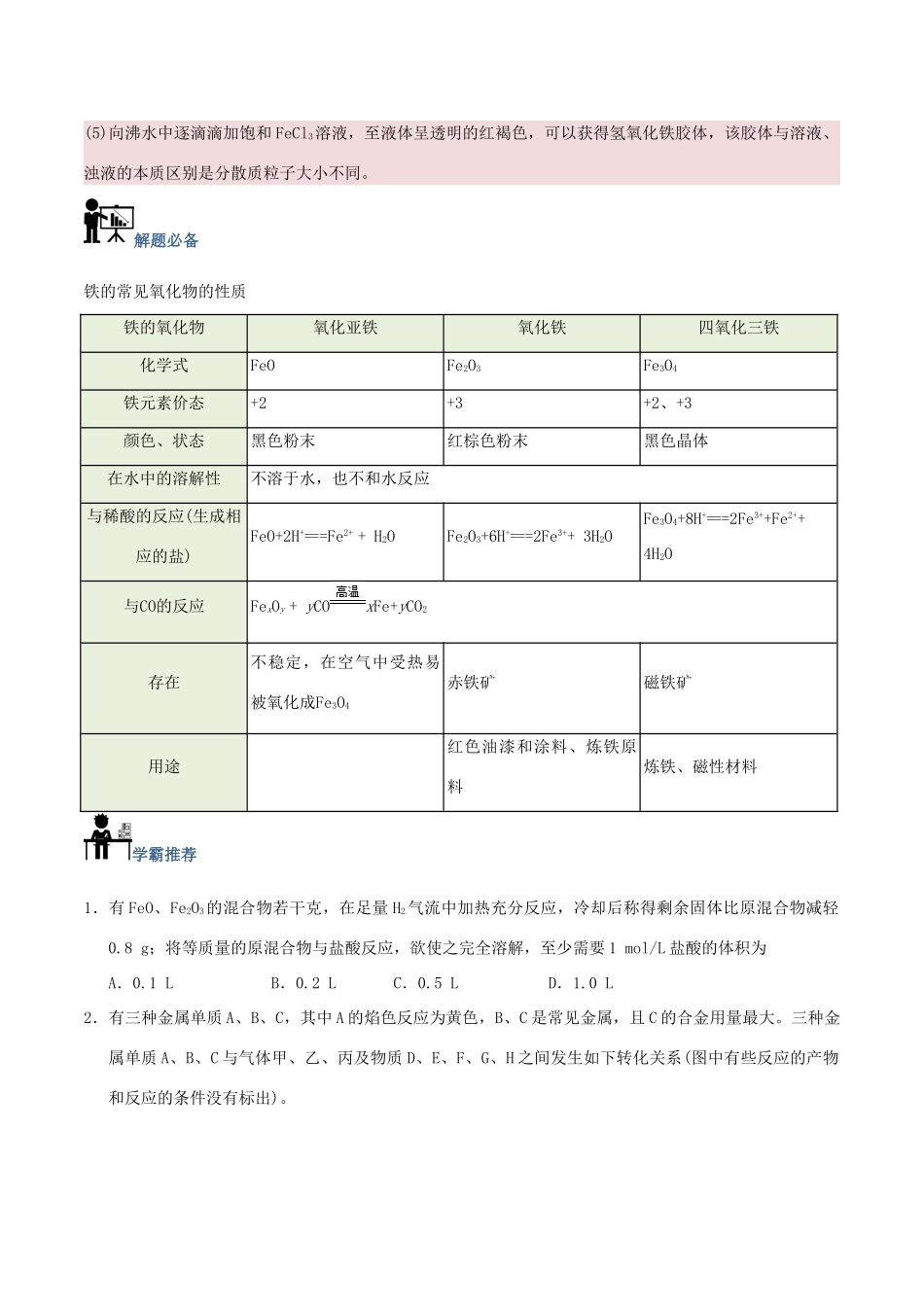
铁的氧化物高考频度:★★★★☆难易程度:★★★☆☆典例在线某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:(1)请写出Fe2O3与①反应的离子方程式______________________________。(2)物质②为_______________。(3)请写出FeCl3与铁粉反应的化学方程式________________________。(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。【答案】(1)Fe2O3+6H+===2Fe3++3H2O(2)NaOH溶液(其它合理答案也可)(3)Fe+2FeCl3===3FeCl3(4)生成白色沉淀,迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2+2H2O===4Fe(OH)3(5)Fe(OH)3胶体分散质粒子大小不同【解析】(1)Fe2O3是碱性氧化物,与盐酸反应生成FeCl3,离子方程式为Fe2O3+6H+===2Fe3++3H2O。(2)FeCl3与NaOH反应生成Fe(OH)3。(3)铁粉可以和三价铁之间发生氧化还原反应,化学方程式为:Fe+2FeCl3===3FeCl2。(4)FeCl2溶液中滴加NaOH生成白色的Fe(OH)2,迅速变成灰绿色,最终被氧化为红褐色的Fe(OH)3,方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,可以获得氢氧化铁胶体,该胶体与溶液、浊液的本质区别是分散质粒子大小不同。解题必备铁的常见氧化物的性质铁的氧化物氧化亚铁氧化铁四氧化三铁化学式FeOFe2O3Fe3O4铁元素价态+2+3+2、+3颜色、状态黑色粉末红棕色粉末黑色晶体在水中的溶解性不溶于水,也不和水反应与稀酸的反应(生成相应的盐)FeO+2H+===Fe2++H2OFe2O3+6H+===2Fe3++3H2OFe3O4+8H+===2Fe3++Fe2++4H2O与CO的反应FexOy+yCOxFe+yCO2存在不稳定,在空气中受热易被氧化成Fe3O4赤铁矿磁铁矿用途红色油漆和涂料、炼铁原料炼铁、磁性材料学霸推荐1.有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,至少需要1mol/L盐酸的体积为A.0.1LB.0.2LC.0.5LD.1.0L2.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:(1)写出下列物质的化学式:A_______、H________、乙_______,C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是________________。(2)写出下列反应的化学方程式:反应①____________________________________________________________________;反应②____________________________________________________________________。(3)检验溶液G中金属阳离子的常用方法是______________________________________________。参考答案1.【答案】A2.【答案】(1)NaAl(OH)3Cl2Fe3O4(2)Fe+2HCl===FeCl2+H2↑2Al+2NaOH+2H2O===2NaAlO2+3H2↑(3)取适量G溶液于试管中,加入KSCN溶液,溶液显红色【解析】解答本题的三个“题眼”:(1)乙为黄绿色气体,说明乙为Cl2。(2)A是焰色反应为黄色的金属,说明A为Na。(3)H为红褐色沉淀,说明H为Fe(OH)3。金属A(Na)与H2O反应生成NaOH和H2,推知甲为H2,D为NaOH,进一步推知金属B为Al,气体丙为HCl,溶液E为盐酸,溶液G中含有Fe3+;因为C为金属,且C的合金用量最大,推知C为Fe,由此确定G为FeCl3。