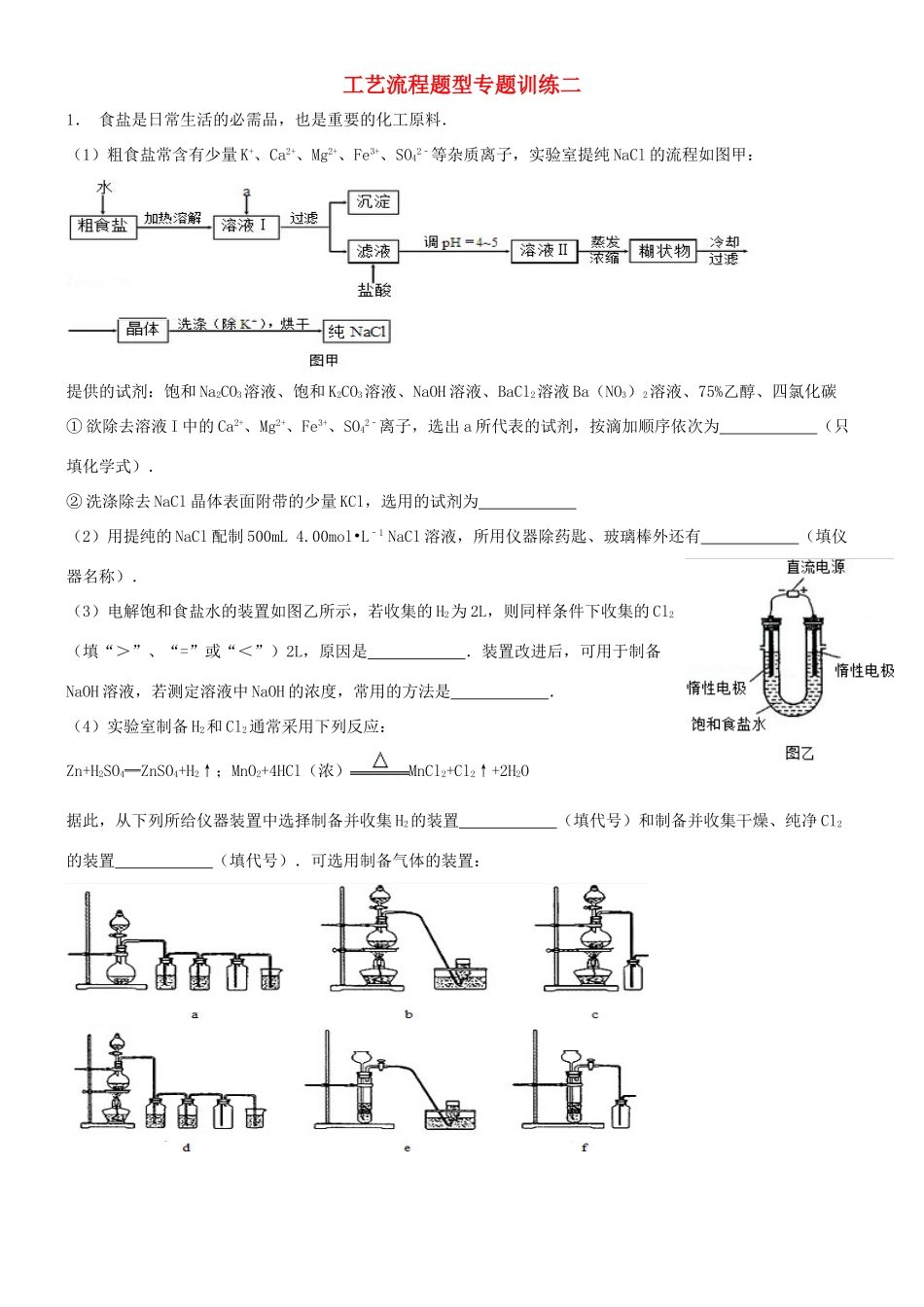
工艺流程题型专题训练二1.食盐是日常生活的必需品,也是重要的化工原料.(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图甲:提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液Ba(NO3)2溶液、75%乙醇、四氯化碳①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42﹣离子,选出a所代表的试剂,按滴加顺序依次为(只填化学式).②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为(2)用提纯的NaCl配制500mL4.00mol•L﹣1NaCl溶液,所用仪器除药匙、玻璃棒外还有(填仪器名称).(3)电解饱和食盐水的装置如图乙所示,若收集的H2为2L,则同样条件下收集的Cl2(填“>”、“=”或“<”)2L,原因是.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是.(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4═ZnSO4+H2↑;MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置(填代号)和制备并收集干燥、纯净Cl2的装置(填代号).可选用制备气体的装置:2.聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),过程如图1:(1)验证固体W焙烧后产生的气体含有SO2的方法是:.(2)实验室制备、收集干燥的SO2,所需仪器如图2.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→→→→→f.装置A中发生反应的化学方程式为.(3)制备绿矾时,向溶液X中加入过量,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾.过滤所需的玻璃仪器有.(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”).(5)溶液Z的pH影响聚铁中铁的质量分数.若溶液Z的pH偏小,将导致聚铁中铁的质量分数(填“偏大”、“偏小”或“无影响”).3.某科研小组以难溶性钾长石(K2O.Al2O3.6SiO2)为原料,提取A1203、K2CO3等物质,工艺流程如下:(1)“煅烧”过程中有如下反应发生:①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式.(2)已知NaAlO2和KAlO2易发生如下反应:AlO+2H2O⇌Al(OH)3+OH﹣.“浸取”时,应保持溶液呈性(填“酸”或“碱”).“浸取”时不断搅拌的目的是(3)“转化”时加入NaOH的主要作用是(用离子方程式表示).(4)上述工艺中可以循环利用的主要物质是、和水.4.LiPF6是锂离子电池中广泛应用的电解质.某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃.(1)第①步反应中无水HF的作用是、.反应设备不能用玻璃材质的原因是(用化学方程式表示).无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的溶液冲洗.(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:.(3)第④步分离采用的方法是;第⑤步分离尾气中HF、HCl采用的方法是.(4)LiPF6产品中通常混有少量LiF.取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为mol(用含w、n的代数式表示).5.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:(1)硫酸渣的成分中属于两性氧化物的是,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式:;(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)沉淀物Fe(OH)3Al(OH)3Fe(OH)2Mg(OH)2开始沉淀2.73.87.59.4完全沉淀3.25.29.712.4(3)滤渣A的主要成分为,滤液B可以回收的物质有;(4)简述洗涤过程的实验操作;(5)已知硫酸渣质量为wkg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红...