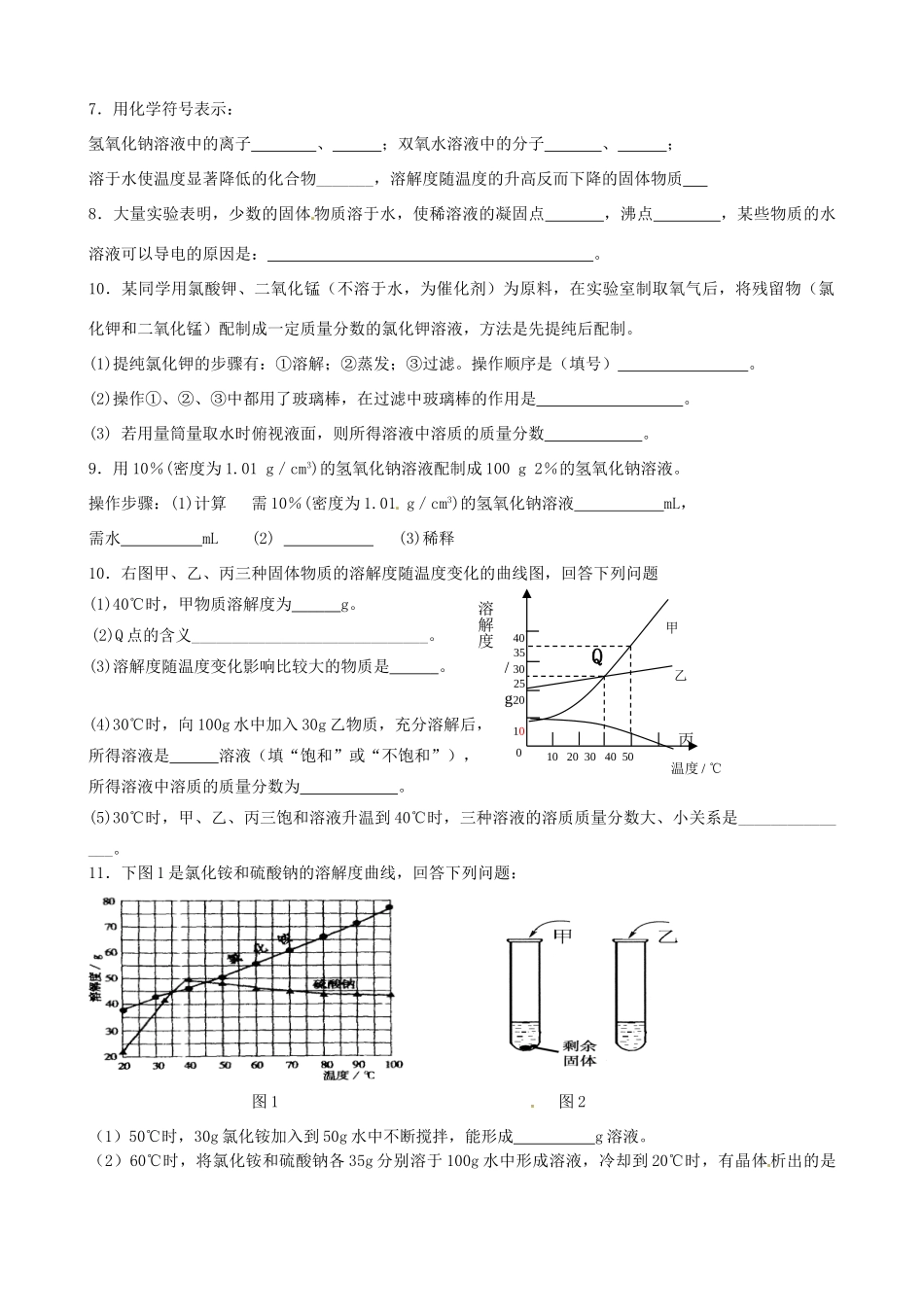
第六章溶解现象1.下列清洗方法中有乳化现象的是:()A.用自来水洗手B.用汽油清洗油污C.用盐酸洗涤水垢D.用洗涤剂清洗餐具2.如图6-10所示,向小试管中分别加入下列一定量的物质;右侧U型管中的液面未发生明显变化。该物质应是A.硝酸铵固体B.氢氧化钠固体C.食盐固体D.氧化钙固体()3.将浓度为38%、密度为1.19g/cm3的浓盐酸稀释成10%稀盐酸,需用到()A.量筒、烧杯、玻璃棒、胶头滴管B.量筒、漏斗、烧杯、胶头滴管C.托盘天平、烧杯、玻璃棒、量筒D.量筒、托盘天平、烧杯、玻璃棒4.右图是A、B、C三种物质的溶解度曲线。下列说法错误的是()A.C的溶解度随温度的升高而减小B.t2℃时A、B、C的溶解度大小为A=B>CC.t2℃A、B、C的饱和溶液降温到t1℃时,A、C两溶液中溶质的质量分数相等D.t1℃时,A的饱和溶液中溶质质量分数为20%。5.给10%的硫酸溶液通电(实质是电解水,硫酸不发生化学变化)以测定水的组成,下面是四组实验后获得的数据,你认为其中最接近理论值的一组是:()氧气质量(克)氢气质量(克)硫酸的质量分数A64810%B10210%C16211%D163211%6.①、②、③、④四个烧杯分别盛有50g水,在20℃时,向四个烧杯中依次加入27g、9g、36g、18g的NaCl,充分溶解后的情况如图所示,则下列叙述不正确的是:()①②③④A.①③溶液的溶质质量分数相等;B.②中所得溶液一定是不饱和溶液;C.④所得溶液的溶质质量分数为36%;D.20℃时,如果①②中的物质混合后刚好达到饱和,则④中溶液一定饱和7.用化学符号表示:氢氧化钠溶液中的离子、;双氧水溶液中的分子、;溶于水使温度显著降低的化合物_______,溶解度随温度的升高反而下降的固体物质8.大量实验表明,少数的固体物质溶于水,使稀溶液的凝固点,沸点,某些物质的水溶液可以导电的原因是:。10.某同学用氯酸钾、二氧化锰(不溶于水,为催化剂)为原料,在实验室制取氧气后,将残留物(氯化钾和二氧化锰)配制成一定质量分数的氯化钾溶液,方法是先提纯后配制。(1)提纯氯化钾的步骤有:①溶解;②蒸发;③过滤。操作顺序是(填号)。(2)操作①、②、③中都用了玻璃棒,在过滤中玻璃棒的作用是。(3)若用量筒量取水时俯视液面,则所得溶液中溶质的质量分数。9.用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成100g2%的氢氧化钠溶液。操作步骤:(1)计算需10%(密度为1.01g/cm3)的氢氧化钠溶液mL,需水mL(2)(3)稀释10.右图甲、乙、丙三种固体物质的溶解度随温度变化的曲线图,回答下列问题(1)40℃时,甲物质溶解度为g。(2)Q点的含义_____________________________。(3)溶解度随温度变化影响比较大的物质是。(4)30℃时,向100g水中加入30g乙物质,充分溶解后,所得溶液是溶液(填“饱和”或“不饱和”),所得溶液中溶质的质量分数为。(5)30℃时,甲、乙、丙三饱和溶液升温到40℃时,三种溶液的溶质质量分数大、小关系是_______________。11.下图1是氯化铵和硫酸钠的溶解度曲线,回答下列问题:图1图2(1)50℃时,30g氯化铵加入到50g水中不断搅拌,能形成g溶液。(2)60℃时,将氯化铵和硫酸钠各35g分别溶于100g水中形成溶液,冷却到20℃时,有晶体析出的是乙甲1020304050温度/℃溶解度0403020103525/g丙Q。(3)将40℃时上述两种物质的饱和溶液分别升温至45℃,所得氯化铵溶液的溶质质量分数(填“>”、“<”或“=”)硫酸钠的溶质质量分数。(4)80℃时,将氯化铵和硫酸钠各6g分别加入到盛有10g水的两支试管中,充分溶解后,可观察到如图2所示的现象。你认为图2中(填“甲”或“乙”)物质是氯化铵。要使剩余的甲固体完全溶解,可以采取的方法是。12.配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。ABCDE请回答下列问题:(1)用上图所示的序号表示正确配制该溶液的操作顺序为。(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应。A.增加适量氯化钠固体B.减少适量氯化钠固体C.调节游码D.添加砝码(3)乙同学在完成“配制50g5%的NaCl溶液”实验过程中,通过计算,需称量NaClg,量取水约mL。将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是。经检测,溶质质量分数偏小,其...