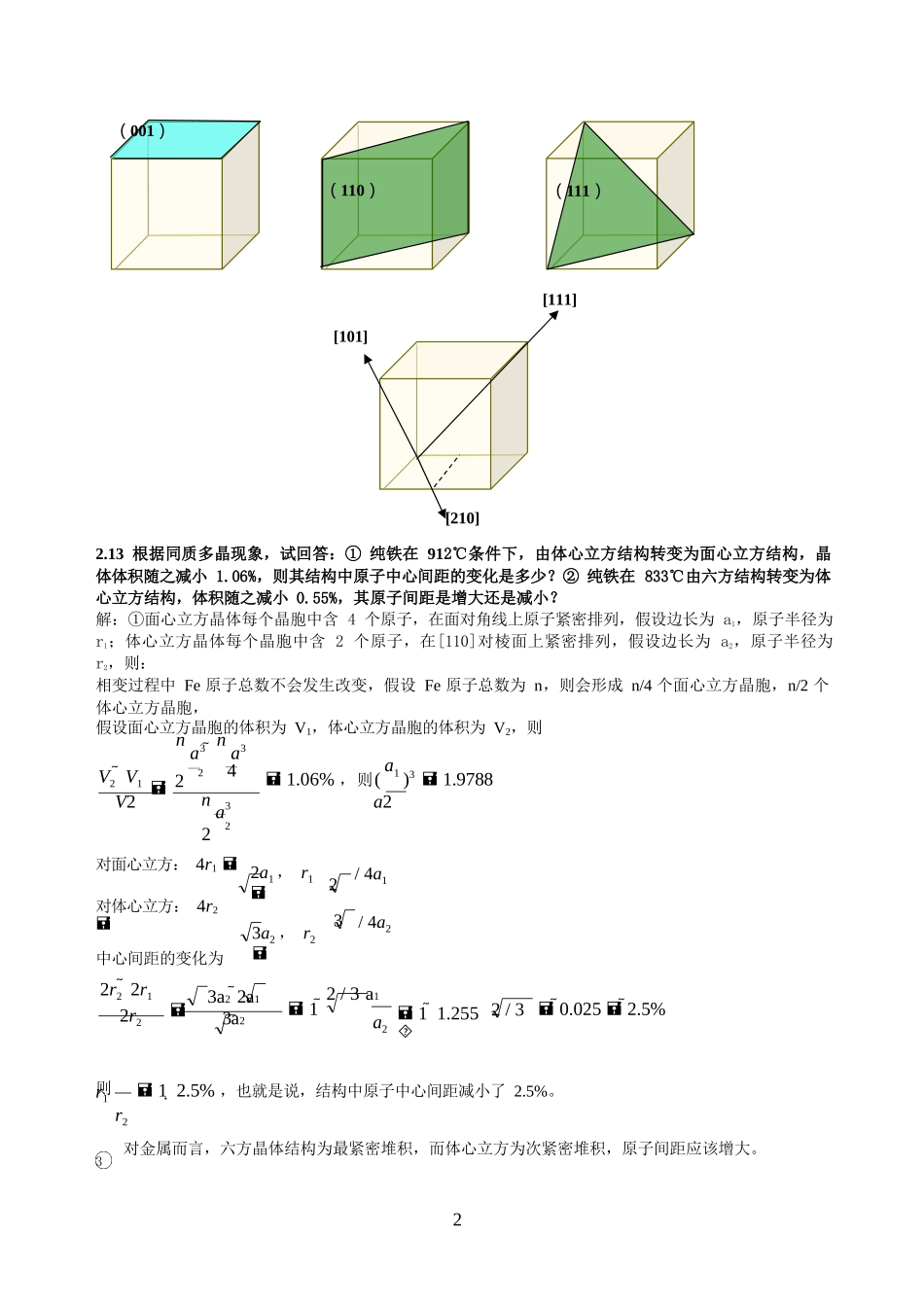
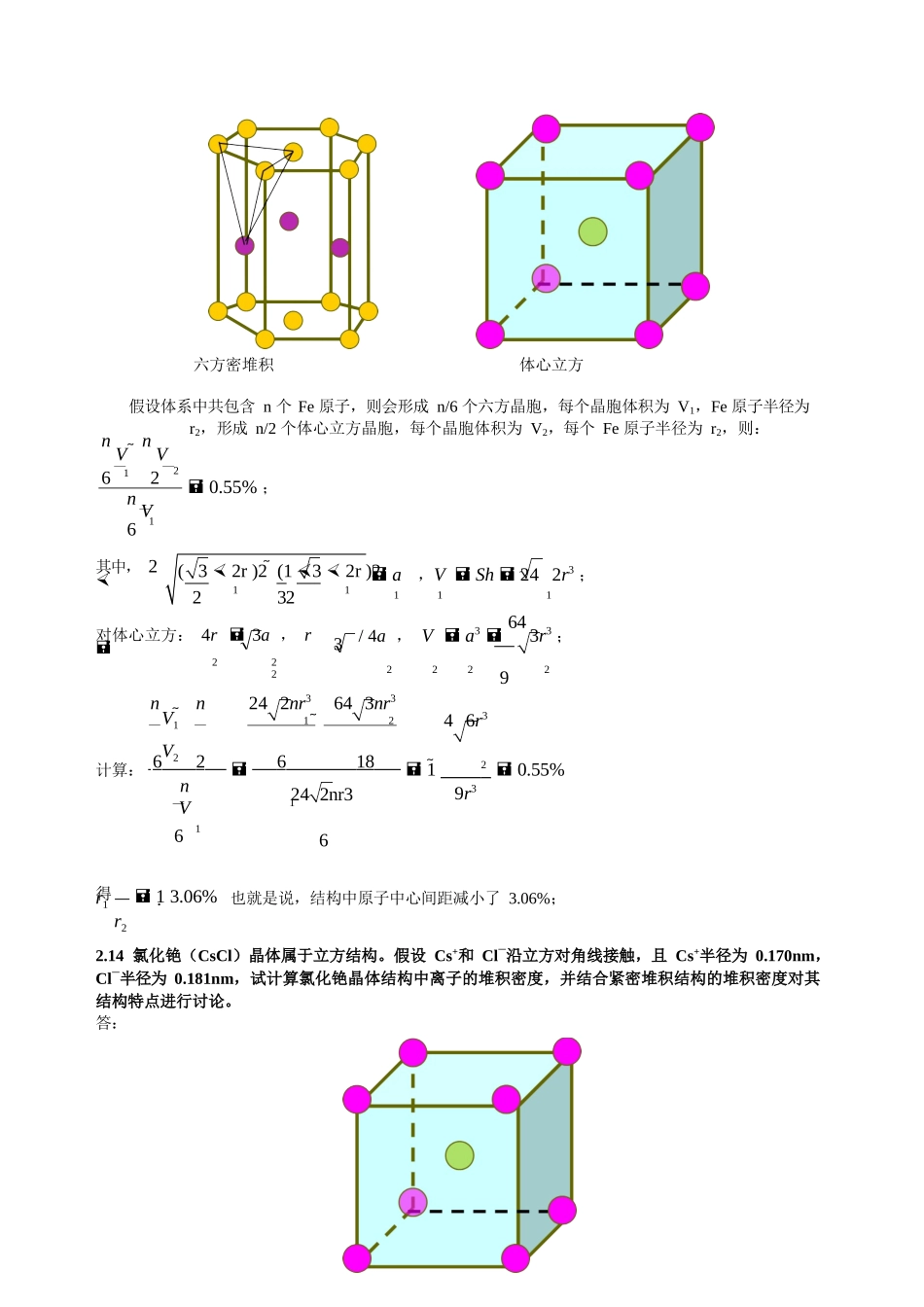
112第一章1.1为什么说无机材料的化学键与电子结构是决定其晶体结构和物理性能的最基本因素?答:晶体结构是晶体中原子或离子按照一定的排列规律在空间周期性重复排列的结果。构成晶体的各原子的电子结构决定了它们按照何种键型结合:离子键、金属键、共价键或分子键。键型是影响晶体中原子配位结构的最主要因素,如纯离子键晶体中离子按照等大球体或不等大球体最紧密堆积方式排列;金属键是离子间的排斥力和电子与离子间引力平衡的结果;共价键中电子排列特点使共价键具有饱和性,原子间只能按照特定的方位结合;极性共价键是离子键向共价键过渡,缩短了部分阴阳离子间的距离,进而影响晶体结构。晶体的物理性质取决于其晶体结构,也最终与材料的化学键和电子结构有关。第二章2.3金属Ni具有立方最紧密堆积的晶体结构,试问:①一个晶胞中有几个Ni原子;②若已知Ni原子的半径为0.125nm,其晶胞的边长为多少?答:一个晶胞中Ni原子个数为:16184个28假设Ni原子半径为r=0.125nm,晶胞边长为a,则:4r2aa22r0.354nm2.4金属Al属立方晶系,其边长为0.405nm,假定其质量密度是2.70g/cm3,试确定其晶胞的布拉菲格子类型。解:要确定晶胞的布拉菲格子实际上就是确定每个晶胞中Al原子的个数每个晶胞的体积为:va3(0.405)3nm30.06643nm36.6431023cm3每个晶胞的质量:mv2.706.6431023g1.7941022g每个晶胞中Al原子个数:nmmAl1.794102227/(6.021023)4由此可以判断金属Al为立方面心格子。2.6试画出立方晶体结构中的下列晶面:(001)、(110)、(111);并分别标出下列晶向:[210]、[111]、[101]。解:1(001)(110)(111)[101][210]22/3a1233a22a13a22/33[111]2.13根据同质多晶现象,试回答:①纯铁在912℃条件下,由体心立方结构转变为面心立方结构,晶体体积随之减小1.06%,则其结构中原子中心间距的变化是多少?②纯铁在833℃由六方结构转变为体心立方结构,体积随之减小0.55%,其原子间距是增大还是减小?解:①面心立方晶体每个晶胞中含4个原子,在面对角线上原子紧密排列,假设边长为a1,原子半径为r1;体心立方晶体每个晶胞中含2个原子,在[110]对棱面上紧密排列,假设边长为a2,原子半径为r2,则:相变过程中Fe原子总数不会发生改变,假设Fe原子总数为n,则会形成n/4个面心立方晶胞,n/2个体心立方晶胞,假设面心立方晶胞的体积为V1,体心立方晶胞的体积为V2,则na3na3V2V12241.06%,则(a1)31.9788V2na3a222对面心立方:4r1对体心立方:4r2中心间距的变化为2a1,r13a2,r2/4a1/4a22r22r12r21a211.2550.0252.5%则r1r212.5%,也就是说,结构中原子中心间距减小了2.5%。对金属而言,六方晶体结构为最紧密堆积,而体心立方为次紧密堆积,原子间距应该增大。13(32r)2(132r)22132131242nr3六方密堆积体心立方假设体系中共包含n个Fe原子,则会形成n/6个六方晶胞,每个晶胞体积为V1,Fe原子半径为r2,形成n/2个体心立方晶胞,每个晶胞体积为V2,每个Fe原子半径为r2,则:nVnV612nV20.55%;61其中,2a,VSh242r3;对体心立方:4r3a,r111/4a,Va3643r3;22222292nn242nr3643nr3V1V21246r3计算:62618120.55%nV6169r3得r1r213.06%也就是说,结构中原子中心间距减小了3.06%;2.14氯化铯(CsCl)晶体属于立方结构。假设Cs+和Cl—沿立方对角线接触,且Cs+半径为0.170nm,Cl—半径为0.181nm,试计算氯化铯晶体结构中离子的堆积密度,并结合紧密堆积结构的堆积密度对其结构特点进行讨论。答:CC4氯化铯是简立方结构且Cs+和Cl—沿立方体对角线接触,因此,2(rr)3a,a=0.405nm,Va0.0666nm331氯化铯晶胞中氯原子个数为nCl881,铯原子个数为nCs1,二者体积为V4(r33Cs3Cl)0.045nm3所以离子的堆积密度为V68.2%。V其堆积密度小于最紧密堆积密度74%,这是因为Cs+离子半径较大无法填充到Cl-离子做最紧密排列形成的八面体间隙中,导致Cl-被撑开,由6配位变成8配位,晶体结构也由面心立方变成体心立方。2.15氧化锂...