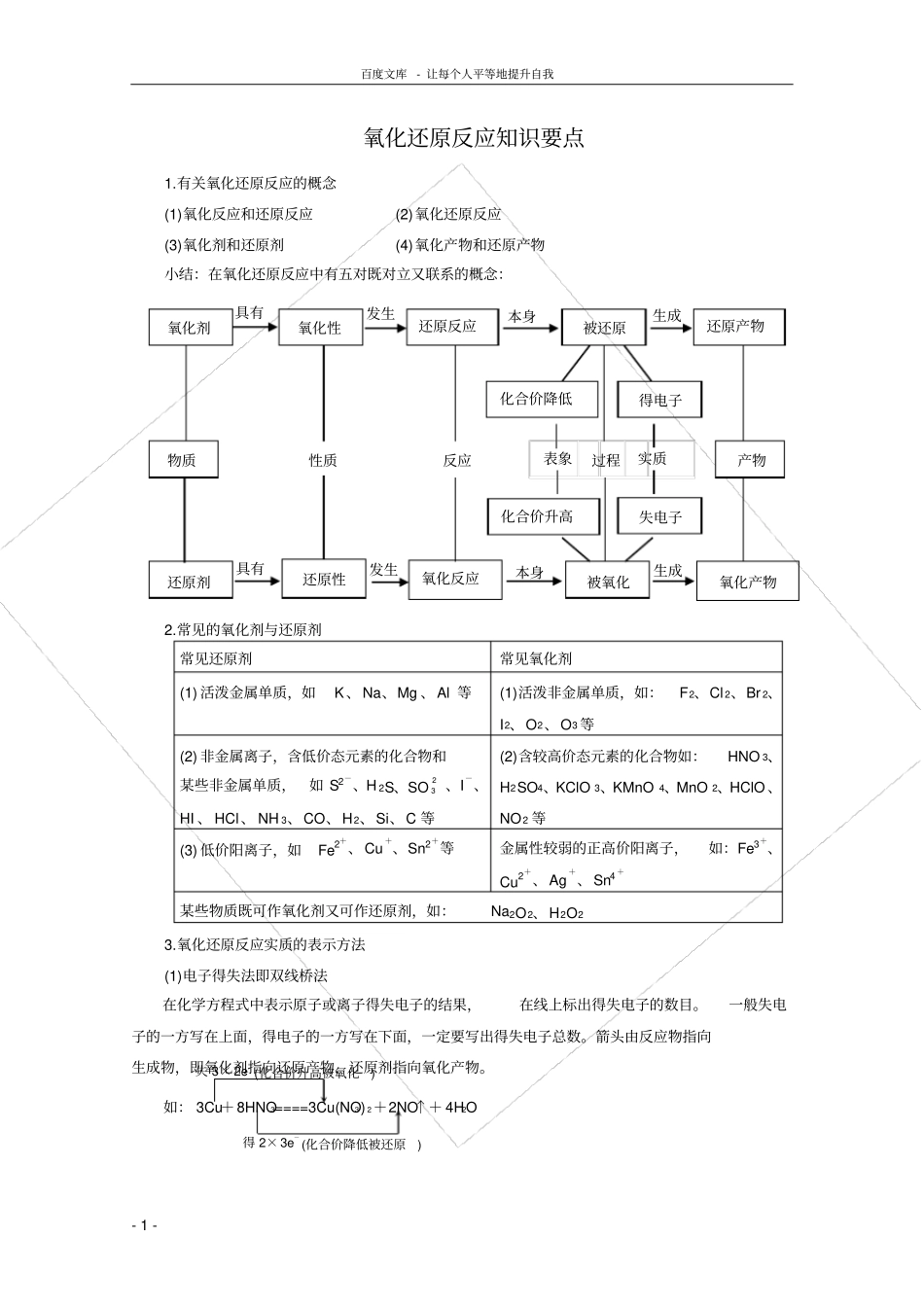
百度文库- 让每个人平等地提升自我- 1 - 氧化还原反应知识要点1.有关氧化还原反应的概念(1)氧化反应和还原反应(2)氧化还原反应(3)氧化剂和还原剂(4)氧化产物和还原产物小结:在氧化还原反应中有五对既对立又联系的概念:2.常见的氧化剂与还原剂常见还原剂常见氧化剂(1) 活泼金属单质,如K、Na、Mg 、Al 等(1)活泼非金属单质,如:F2、Cl 2、Br 2、I2、O2、O3 等(2) 非金属离子,含低价态元素的化合物和某些非金属单质,如 S2-、H 2S、SO23 、I-、HI 、 HCl、 NH 3、CO、H2、Si、C 等(2)含较高价态元素的化合物如:HNO 3、H2SO4、KClO 3、KMnO 4、MnO 2、HClO 、NO 2 等(3) 低价阳离子,如Fe2+、Cu+、Sn2+等金属性较弱的正高价阳离子,如:Fe3+、Cu2+、Ag+、Sn4 +某些物质既可作氧化剂又可作还原剂,如:Na2O2、H2O23.氧化还原反应实质的表示方法(1)电子得失法即双线桥法在化学方程式中表示原子或离子得失电子的结果,在线上标出得失电子的数目。一般失电子的一方写在上面,得电子的一方写在下面,一定要写出得失电子总数。箭头由反应物指向生成物,即氧化剂指向还原产物,还原剂指向氧化产物。失 3× 2e-(化合价升高被氧化) 得 2× 3e- (化合价降低被还原) 如: 3Cu+8HNO3====3Cu(NO3) 2+2NO↑+ 4H2O 物质性质过程反应产物氧化剂得电子失电子还原剂还原性氧化性化合价降低化合价升高被还原被氧化还原反应氧化反应还原产物氧化产物具有具有发生发生表象实质本身本身生成生成百度文库- 让每个人平等地提升自我- 2 - (2)电子转移法即单线桥法在化学方程式中表示原子或离子间电子转移情况,在线上标出电子转移总数,但不写得、失。如: 3Cu+8HNO 3====3Cu(NO 3)2+2NO↑+ 4H2O 箭头由反应物指向反应物,即箭头由还原剂中失电子的元素指向氧化剂中得电子的元素。4.氧化还原反应的一般规律(1)、相等规律在一个氧化还原反应中,氧化剂得到电子的数目等于还原剂失去电子的数目。或者说氧化剂化合价降低总数等于还原剂化合价升高总数。根据这个规律,我们可以进行氧化还原反应方程式的配平以及有关氧化还原反应的计算。(2)表现性质规律:①某种元素处于最高价态时,则含有该元素的物质就具有氧化性。因为在氧化还原反应中,该元素的化合价只能降低,不可再升高。例如:KMnO 4、H 2SO4、HNO 3、FeCl3、F2(无正价)等。②某种元素处于最低价态时,则含有该元素的物质就具有还原性。因...