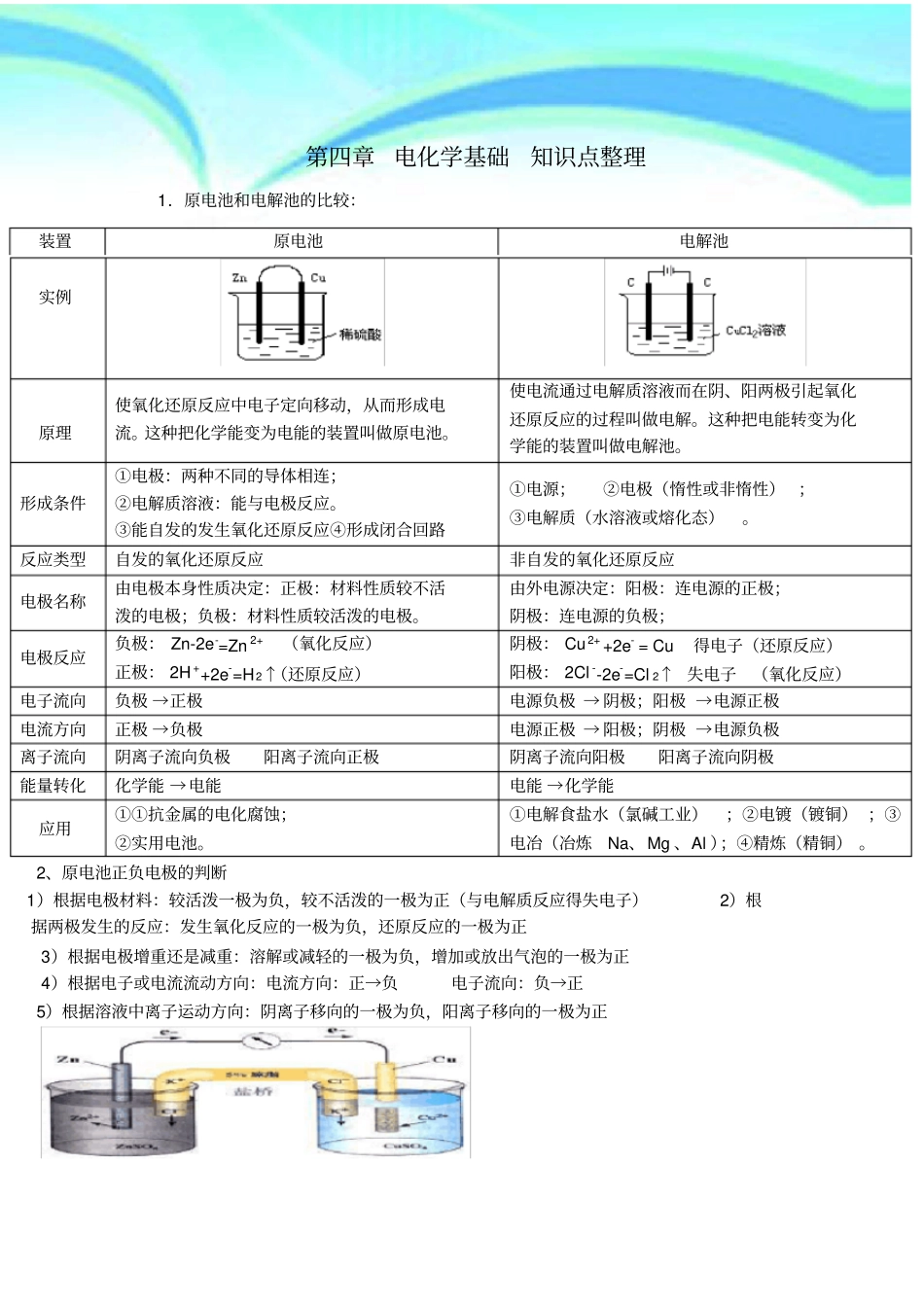
原电池章节知识点总结————————————————————————————————作者:————————————————————————————————日期:第四章电化学基础知识点整理1.原电池和电解池的比较:2、原电池正负电极的判断1)根据电极材料:较活泼一极为负,较不活泼的一极为正(与电解质反应得失电子)2)根据两极发生的反应:发生氧化反应的一极为负,还原反应的一极为正 3)根据电极增重还是减重:溶解或减轻的一极为负,增加或放出气泡的一极为正 4)根据电子或电流流动方向:电流方向:正→负电子流向:负→正5)根据溶液中离子运动方向:阴离子移向的一极为负,阳离子移向的一极为正装置原电池电解池实例原理使氧化还原反应中电子定向移动,从而形成电流。这种把化学能变为电能的装置叫做原电池。使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。这种把电能转变为化学能的装置叫做电解池。形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。③能自发的发生氧化还原反应④形成闭合回路①电源;②电极(惰性或非惰性) ;③电解质(水溶液或熔化态)。反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极: Zn-2e-=Zn 2+ (氧化反应)正极: 2H ++2e-=H2↑(还原反应)阴极: Cu 2+ +2e- = Cu 得电子(还原反应)阳极: 2Cl --2e-=Cl 2↑ 失电子(氧化反应)电子流向负极 →正极电源负极 → 阴极;阳极 →电源正极电流方向正极 →负极电源正极 → 阳极;阴极 →电源负极离子流向阴离子流向负极阳离子流向正极阴离子流向阳极阳离子流向阴极能量转化化学能 →电能电能 →化学能应用①①抗金属的电化腐蚀;②实用电池。①电解食盐水(氯碱工业);②电镀(镀铜) ;③电冶(冶炼Na、Mg 、Al );④精炼(精铜) 。3.正确书写原电池电极反应式(1) 列出正负电电极上的反应物质, 在等式的两边分别写出反应物和生成物(2) 在反应式左边写出得失电子数, 使得失电子数目相等。(得失电子守恒)(3) 使质量守恒。 电极反应式书写时注意: 负极反应生成物的阳离子与电解质溶液中的阴离子是否共存。若不共存, 则该电解质溶液中的阴离子应该写入负极反应式 ; 若正极上的反应物质是O2则...