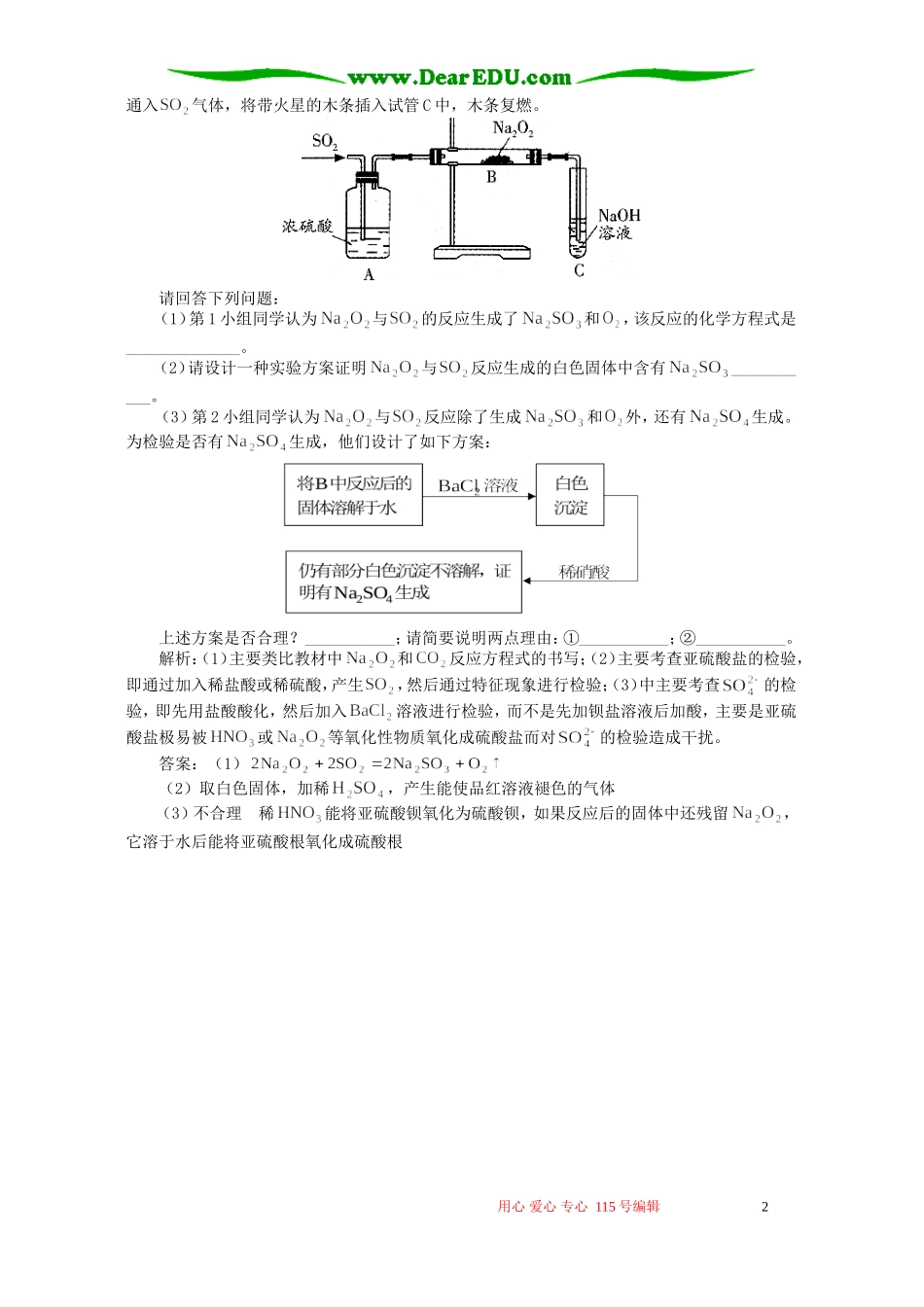
性质实验方案设计的考点归类湖北/田宗学 1、常见性质实验方案设计的规律(1)证明酸性:pH 试纸或酸碱指示剂;与碳酸钠溶液反应;与锌等活泼金属反应。(2)证明弱酸性:证明存在电离平衡;测定对应盐溶液酸碱性;测量稀释后 pH 变化。(3)证明氧化性:与还原剂(如 KI、、等)反应,产生明显的现象。(4)证明还原性:与氧化剂(如、浓等)反应,产生明显的现象。(5)比较金属的活动性:与水反应;与酸反应;置换反应;原电池;电解放电顺序;最高价氧化物的水化物的碱性强弱;对应盐的酸碱性强弱。(6)比较非金属的活动性:置换反应;与氢气反应快慢;气态氢化物的稳定性、还原性;最高价氧化物的水化物的酸性强弱;对应盐的酸碱性强弱。(7)比较酸(碱)的酸(碱)性强弱;较强的酸(碱)能制得较弱的酸(碱),此外还必须掌握常见的阳离子、阴离子的特征反应。 2、考点例析(1)探究性质实验方案的设计基本思路:①分析其物质结构特点或找出所属类型的典型代表物;②推测物质可能具有的一系列性质;③由此设计出合理的实验方案,去探究它所具有的性质。例 1:某同学为了验证海带中含有碘,拟进行如下实验。请回答相关问题。(1)第 1 步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有_________(填编号,限填 3 项)。A、试管B、瓷坩埚C、坩埚钳D、铁三角架E、泥三角F、酒精灯G、烧杯H 量筒(2)第 2 步:I 溶液的获取。操作是____________。(3)第 3 步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用__________(填编号)。A、浓硫酸B、新制氯水C、高锰酸钾溶液D、理由是____________________。(4)(第 4 步):碘单质的检验。操作是取少量第 3 步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。解析:(1)首先分析灼烧固体物质所用的仪器有哪些,然后从中选出硅酸盐质的实验仪器:瓷坩埚、泥三角、酒精灯。应特别注意的是容易漏选酒精灯。(2)灼烧海带后所得的灰烬中含有可溶性碘离子和难溶固体物质,要得到含有碘离子的溶液,必须将灰烬充分溶解,并进行过滤除去残渣。(3)浓硫酸、新制氯水、高锰酸钾溶液、均能将氧化为。前三者会在溶液中引入新的杂质,而的还原产物为无其他物质生成,所以氧化剂最好选用。答案:(1)BEF(2)将灰烬转移到烧杯中,加入适量蒸馏水,用玻璃棒充分搅拌,煮沸、过滤(3)D 过氧化氢是绿色氧化剂,在氧化过程中不引进杂质,...