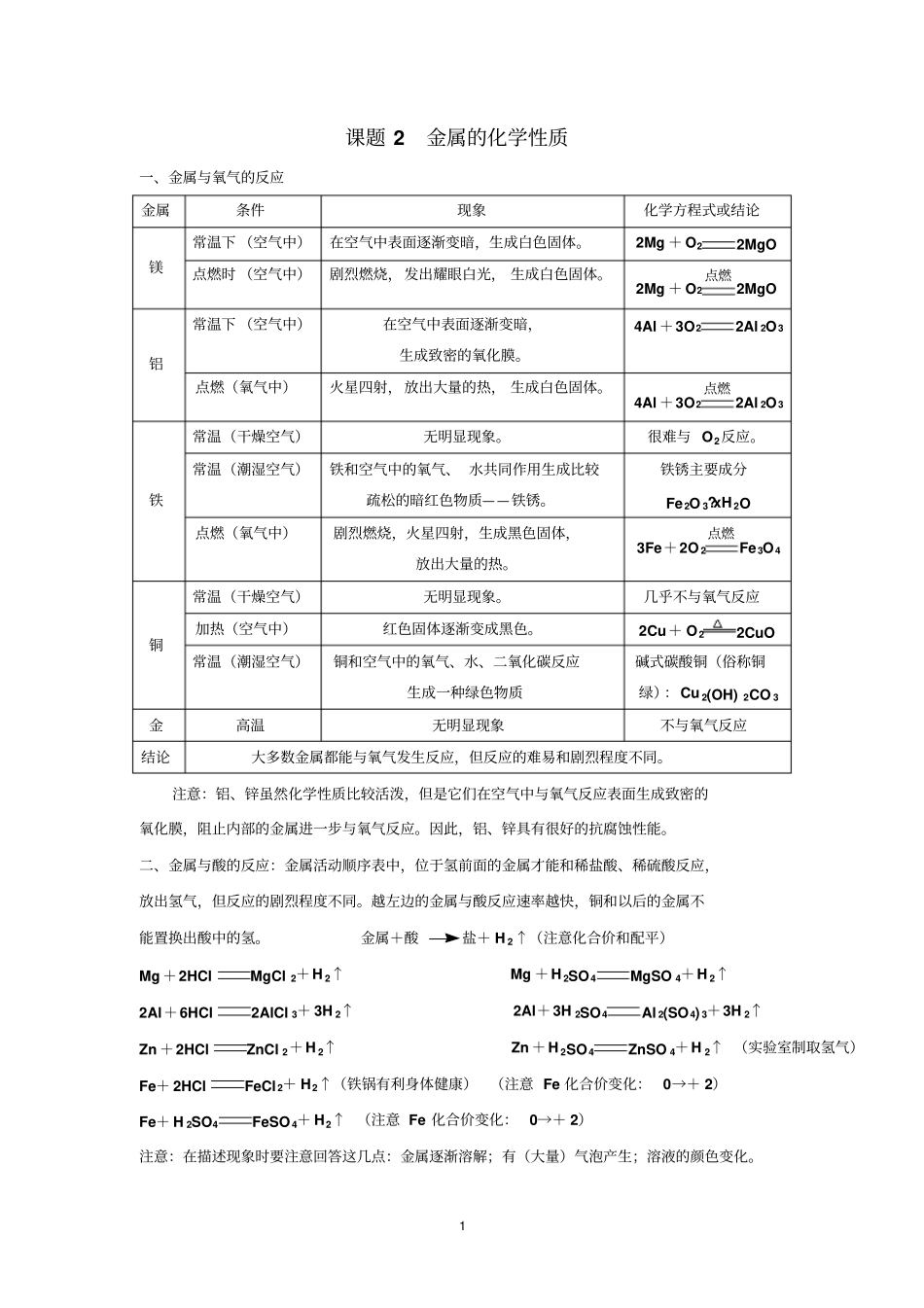
1 课题 2 金属的化学性质一、金属与氧气的反应金属条件现象化学方程式或结论镁常温下 (空气中)在空气中表面逐渐变暗,生成白色固体。2Mg + O22MgO 点燃时 (空气中)剧烈燃烧,发出耀眼白光, 生成白色固体。2Mg + O2点燃2MgO 铝常温下 (空气中)在空气中表面逐渐变暗,生成致密的氧化膜。4Al +3O22Al 2O3点燃(氧气中)火星四射,放出大量的热, 生成白色固体。4Al +3O2点燃2Al 2O3铁常温(干燥空气)无明显现象。很难与 O2反应。常温(潮湿空气)铁和空气中的氧气、 水共同作用生成比较疏松的暗红色物质——铁锈。铁锈主要成分Fe2O 3?xH 2O 点燃(氧气中)剧烈燃烧,火星四射,生成黑色固体,放出大量的热。3Fe+2O 2点燃Fe3O4铜常温(干燥空气)无明显现象。几乎不与氧气反应加热(空气中)红色固体逐渐变成黑色。2Cu+ O22CuO 常温(潮湿空气)铜和空气中的氧气、水、二氧化碳反应生成一种绿色物质碱式碳酸铜(俗称铜绿):Cu 2(OH) 2CO 3金高温无明显现象不与氧气反应结论大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同。注意:铝、锌虽然化学性质比较活泼,但是它们在空气中与氧气反应表面生成致密的氧化膜,阻止内部的金属进一步与氧气反应。因此,铝、锌具有很好的抗腐蚀性能。二、金属与酸的反应:金属活动顺序表中,位于氢前面的金属才能和稀盐酸、稀硫酸反应,放出氢气,但反应的剧烈程度不同。越左边的金属与酸反应速率越快,铜和以后的金属不能置换出酸中的氢。金属+酸盐+ H 2↑(注意化合价和配平)Mg +2HClMgCl 2+H 2↑Mg +H 2SO4MgSO 4+H 2↑2Al+6HCl2AlCl 3+ 3H 2↑2Al+3H 2SO4Al 2(SO4) 3+3H 2↑Zn +2HClZnCl 2+H 2↑Zn +H 2SO4ZnSO 4+H 2↑ (实验室制取氢气)Fe+ 2HClFeCl2+ H2↑(铁锅有利身体健康)(注意 Fe 化合价变化: 0→+ 2)Fe+ H 2SO4FeSO 4+ H2↑ (注意 Fe 化合价变化: 0→+ 2)注意:在描述现象时要注意回答这几点:金属逐渐溶解;有(大量)气泡产生;溶液的颜色变化。2 三、金属与盐溶液的反应:金属活动顺序表中,前面的金属能将后面的金属从它的盐溶液中置换出来。 (钾钙钠除外)金属+盐新金属+新盐Fe+ CuSO 4Cu+FeSO 4(铁表面被红色物质覆盖,溶液由蓝色逐渐变成浅绿色)(注意 Fe 化合价变化: 0→+ 2)不能用铁制器皿盛放波尔多液,湿法炼铜的原理Cu+2AgNO 32Ag+ Cu(N...