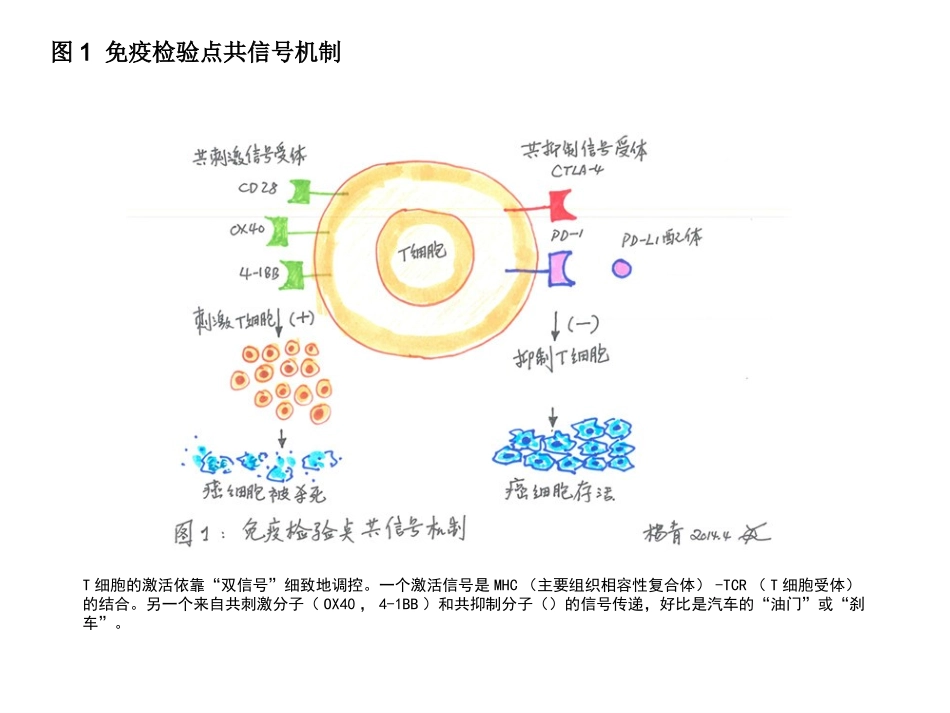
T细胞的激活依靠“双信号”细致地调控。一个激活信号是MHC(主要组织相容性复合体)-TCR(T细胞受体)的结合。另一个来自共刺激分子(OX40,4-1BB)和共抑制分子()的信号传递,好比是汽车的“油门”或“刹车”。图1免疫检验点共信号机制图2免疫检验点抗体作用机理肿瘤细胞入侵后,会压制T-细胞激活,从而逃脱免疫系统的围剿。如果我们能用针对OX40、4-1BB的激活剂单抗来“猛踩油门”,或针对CTLA-4、PD-1/PD-L1的拮抗剂单抗来“松开刹车”,T细胞都可以摆脱肿瘤细胞的压制,重新被激活来识别杀伤肿瘤细胞。图3嵌合抗原受体CAR自体T细胞疗法嵌合抗原受体(CAR)是一种个性化的治疗方法。病人的T细胞通过基因工程修饰,加上一个嵌合蛋白。经过嵌合蛋白修饰的T细胞仿佛带上了一个“向导”,能像巡航导弹一样,识别攻击带有CD19抗原的肿瘤细胞并引发免疫反应。图4嵌合抗原受体CAR的演化CAR技术自1989年起,经过三代演进:第一代只有T细胞刺激因子,没有共刺激因子;第二代只有单个共刺激因子;第三代才有两个共刺激因子。这些改进都是基于一系列临床试验,对CAR的有效性有显着提高。T细胞膜表面有100多种特异性抗原,现已制备了多种单克隆抗体,WHO(1986)统称为白细胞分化抗原(clusterdifferentiation,CD)。例如CD3代表总T细胞,CD4代表辅助性T细胞(TH),CD8代表细胞毒性T细胞(TC)等。TCRCD3CD8MHCⅠ肽TCRCD3CD4Th细胞MHCⅡ肽细胞毒性T细胞与辅助性T细胞APCAPCTc细胞CD4:是T细胞TCR-CD3识别抗原的辅助受体,受MHC-II类分子限制CD8:是T细胞TCR-CD3识别抗原的辅助受体,受MHC-I类分子限制CD28/CTLA-4(CD152):其配体是B7家族(B7-1/CD80、B7-2/CD86)是T细胞活化/抑制最重要的协同刺激分子ICOS:表达活化的T细胞,配体为ICOSL/B7-H2,是T细胞活化的协同刺激信号,主要在CD28后发挥作用CD2(LFA-2):又称SRBCR,其配体是CD58(LFA-3),可介导T细胞旁路激活途径CD40L:参与B细胞的免疫应答LFA-1:其配体是ICAM,介导T细胞与靶细胞间的相互作用,促进细胞免疫应答效应丝裂原受体:PHAR、ConARTLYMPHOCYTETCRCD8B7CD28APCCTLTc细胞TCRCD8CD40LCTLA-4TLRsB7:CD28/CTLA-4T细胞活化/抑制的协同刺激信号ICOS:ICOSL/B7-H2T细胞活化的协同刺激信号CD2(LFA-2/SRBCR):CD58(LFA-3)介导T细胞旁路激活途径CD40L:CD40参与B细胞的免疫应答LFA-1:ICAM介导T细胞与靶细胞间的相互作用,促进细胞免疫应答效应CD3靶细胞MHCⅠ穿孔素/颗粒酶FasL/FasCD8+杀伤性T(Tc/CTL)细胞杀伤过程:•效靶接触:(TCR-CD3)—(抗原肽-MHC)•分泌介质:穿孔素、颗粒酶•靶细胞裂解:渗透性溶解杀伤机理:•释放穿孔素和颗粒酶•诱导凋亡:通过Fas和FasL结合,激活半胱天冬氨酸蛋白酶(caspase8)导致细胞死亡TLYMPHOCYTET细胞共刺激一旦TCR参与,T细胞同样也会接收到共刺激,从TCR传出的信号就会被放大很多倍,因此,只需极少量(约1/100)的TCR参与就可激活原初T细胞。所以,在激活前,除了原初T细胞的受体应与MHC-肽结合外,还必须接收到共刺激信号。共刺激就好像一个“扩增器”,可以用来放大由TCR发出的“我参战了”的信号,从而降低必须与MHC-肽复合物交联的TCR阈值。TCRCD4CD4+NaïveTh细胞B7CD28B7B7-1:CD80B7-2:CD86CD28T细胞激活CTLA-4:CD152T细胞去活化受体TCRCD4激活CD4+TCD40LCTLA-4CD40TLRsTh1Th2Th17TregAPCB细胞CD40Th3TLYMPHOCYTE与T细胞活化相关分子CD4+辅助性T(CD4+Th)细胞•Th-1细胞:分泌IL-2、IFN-、TNF等,促进吞噬细胞、Tc细胞和NK细胞的吞噬杀伤功能及炎症反应的发生,促进T细胞的增殖和分化,介导细胞免疫效应和迟发型超敏反应的发生•Th-2细胞:分泌IL-4、IL-5、IL-6、IL-10,促进B细胞的分化和成熟,增强B细胞介导的体液免疫效应•Th-3细胞:分泌TGF-,抑制细胞免疫应答和体液免疫应答•Th17细胞:分泌IL-17参与固有免疫应答和炎症反应•Tr细胞:分泌IL-10抑制巨噬细胞和Th1细胞活性,参与调节作用TLYMPHOCYTETr直接与靶细胞接触产生抑制效应下调靶细胞的IL-2R的表达,抑制靶细胞增殖抑制APC对抗原的呈递,减低活化信号的刺激CD4+CD25+调...