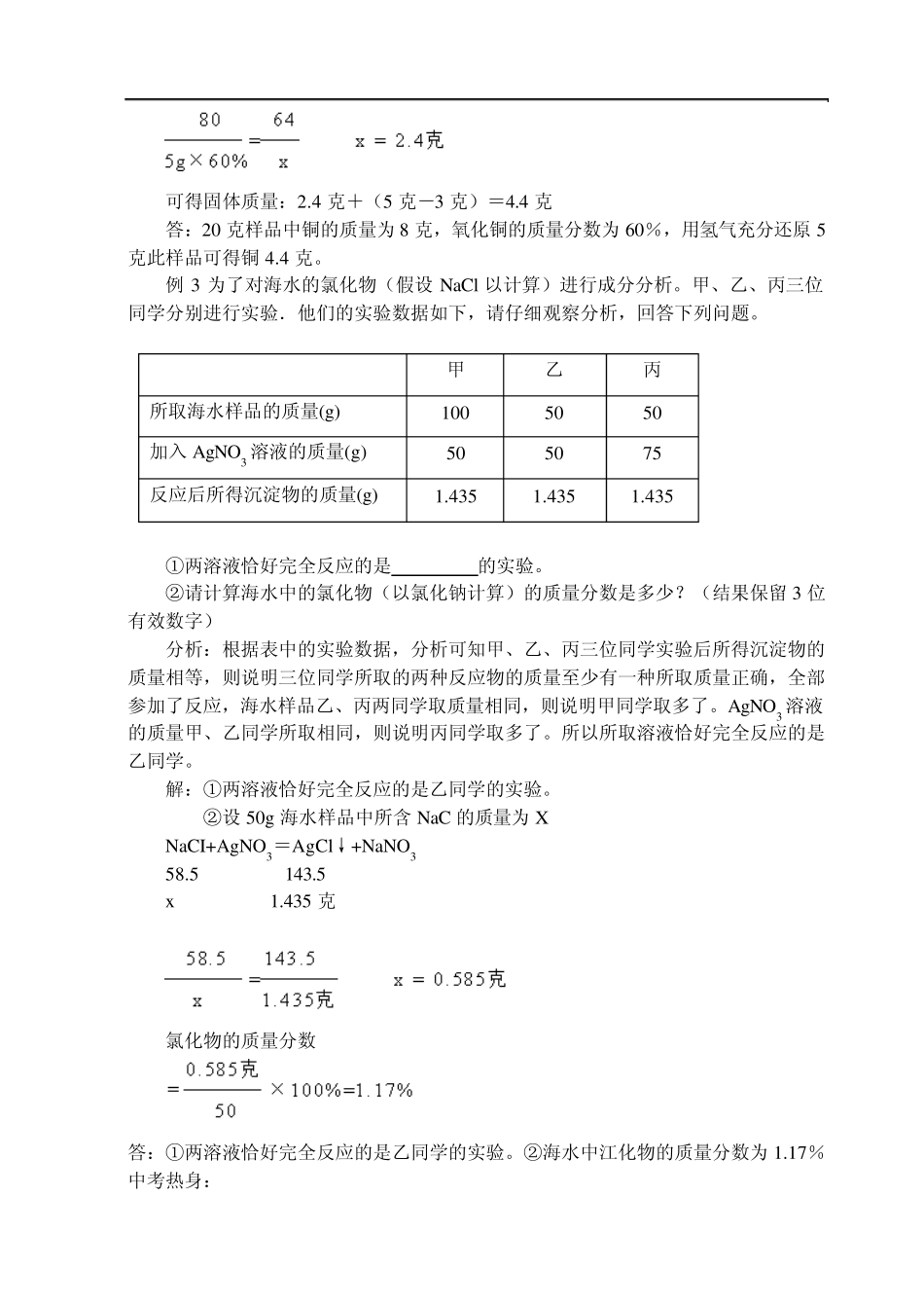
化学专题辅导四 有关化学方程式的计算 考点剖析: 1、有关化学方程式计算的基本类型 ①反应物、生成物都是纯净物的计算 ②反应物或生成物中含有一定量的杂质的计算 ③关于混合物的计算(只要求掌握混合物中有一种成分参加反应的计算) 2、解题步骤 ①设未知量; ②正确写出有关化学方程式; ③找出已知量和未知量的质量关系; ④列出比例式,求出未知量; ⑤检查结果,写出答案。 3、根据化学方程式计算应注意的事项 ①正确书写化学方程式,准确列出有关反应物或生成物的质量比。 ②列式时,各物质的质量单位必须统一,对应关系要正确。 ③反应物、生成物必须是纯净物,如果不是纯净物,应将不纯物质的质量按题意换算成纯净物的质量。 ④在溶液中进行的反应,应用溶质的质量代入化学方程式进行计算,而不能用溶液的质量代入计算。 ⑤解题过程要完整规范。 4、有关计算公式 ①纯净物的质量=混合物的质量×物质的纯度(或质量分数) ②纯净物的质量分数=1-杂质的质量分数 ③ 例题精析: 例1 在托盘天平的两盘上,各放一盛有等质量分数足量稀盐酸的烧杯,调节天平至平衡。向左盘烧杯中加入8 克氧化镁,若使天平仍然平衡,需向右盘烧杯中加人多少克铝? 分析:由 MgO+2HCl=MgCl2+H2O 可知,左盘烧杯中增加的质量就是所加的MgO 的质量。要使天平仍然平衡,右盘烧杯中物质的质量也应增加8 克。而铝会与稀盐酸反应并生成H2 逸出,所以加入铝的质量必定大于8 克。(mAl-mH2=8 克) 解:设需要加入铝的质量为 x 54 6 54 —6 x 8 克 x=9 克 答:需向右盘烧杯中加人9 克铝。 例2 某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20 克此样品,分四次向其中加入稀盐酸与之充分反应。每次所用盐酸的体积与反应后剩余固体的质量见下表: 加入稀盐酸的体积/ml 剩余固体的/g 1 40 16 2 40 12 3 40 8 4 40 8 求:①20g 此样品中铜的质量; ②样品中氧化铜的质量分数; ③用氢气充分还原5g 此样品可得固体多少克? 分析:根据表格中的数据分析可知第三、四次剩余团体均为8 克,说明该剩余固体不能与盐酸反应,这8 克固体一定是铜。 解:①20g 样品中铜的质量为8g ②样品中氧化铜的质量分数: ③设用H2 还原5g 此样品可生成铜的质量为x 80 64 5g×60% x 可得固体质量:2.4 克+(5 克-3 克)=4.4 克 答:20 克样品中铜的质量为8 克,氧化铜的质量...