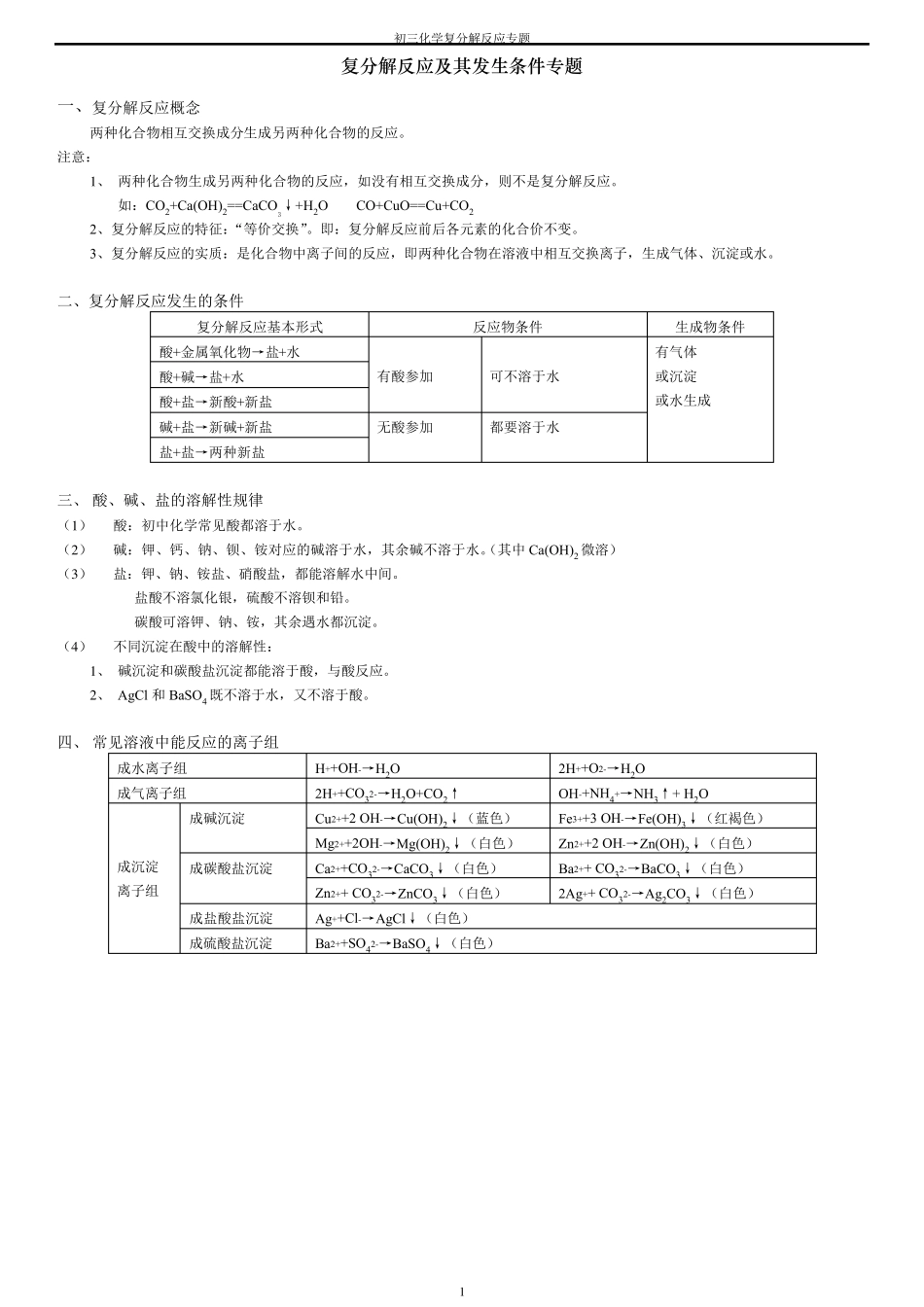
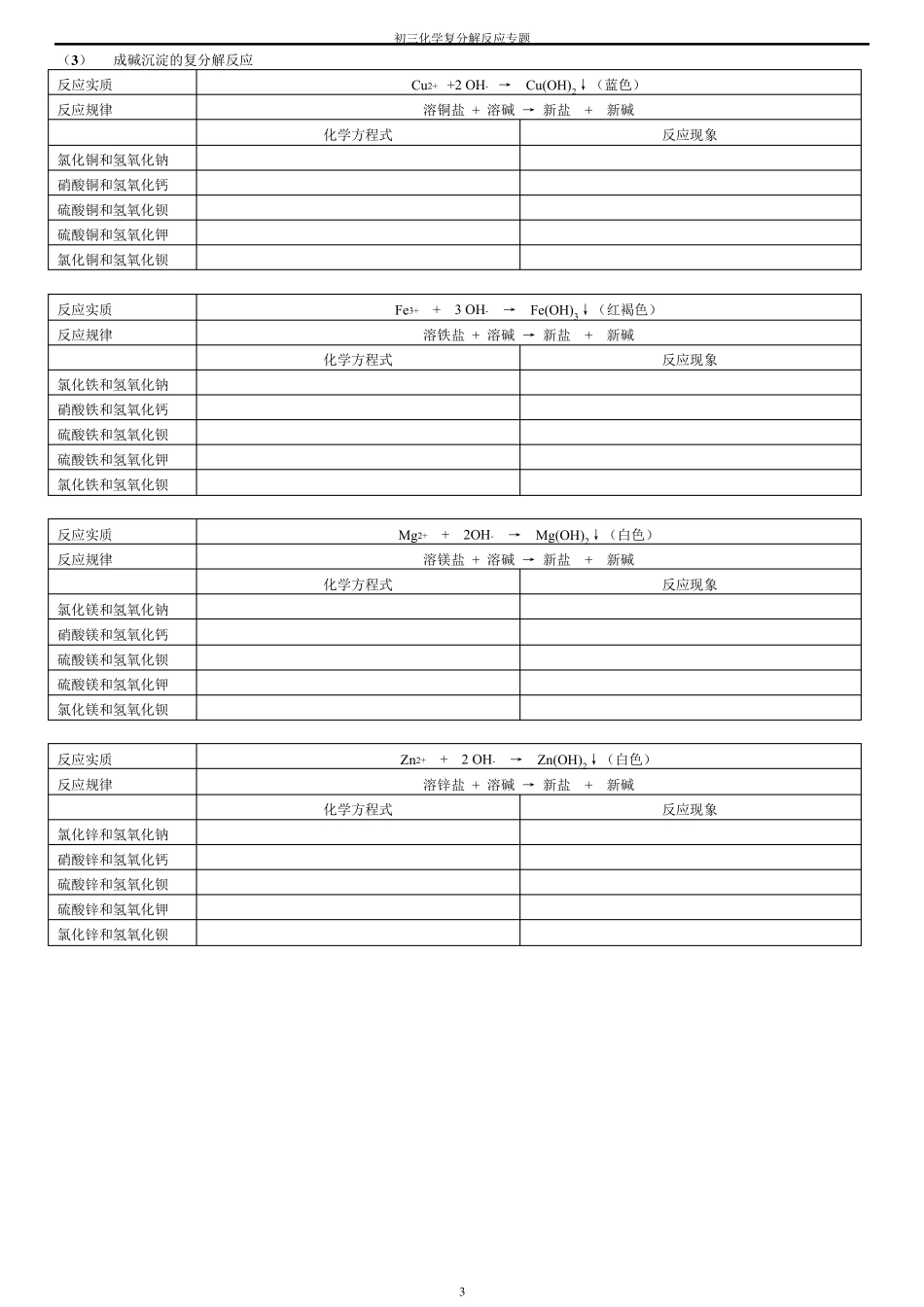
初三化学复分解反应专题 1 复 分 解 反 应 及 其 发 生 条 件 专 题 一、复分解反应概念 两种化合物相互交换成分生成另两种化合物的反应。 注意: 1 、 两种化合物生成另两种化合物的反应,如没有相互交换成分,则不是复分解反应。 如:CO2+Ca(OH)2==CaCO3↓+H2O CO+CuO==Cu+CO2 2、复分解反应的特征:“等价交换”。即:复分解反应前后各元素的化合价不变。 3、复分解反应的实质:是化合物中离子间的反应,即两种化合物在溶液中相互交换离子,生成气体、沉淀或水。 二、复分解反应发生的条件 复分解反应基本形式 反应物条件 生成物条件 酸+金属氧化物→盐+水 有酸参加 可不溶于水 有气体 或沉淀 或水生成 酸+碱→盐+水 酸+盐→新酸+新盐 碱+盐→新碱+新盐 无酸参加 都要溶于水 盐+盐→两种新盐 三、 酸、碱、盐的溶解性规律 (1 ) 酸:初中化学常见酸都溶于水。 (2 ) 碱:钾、钙、钠、钡、铵对应的碱溶于水,其余碱不溶于水。(其中 Ca(OH)2 微溶) (3 ) 盐:钾、钠、铵盐、硝酸盐,都能溶解水中间。 盐酸不溶氯化银,硫酸不溶钡和铅。 碳酸可溶钾、钠、铵,其余遇水都沉淀。 (4 ) 不同沉淀在酸中的溶解性: 1 、 碱沉淀和碳酸盐沉淀都能溶于酸,与酸反应。 2 、 AgCl 和 BaSO4 既不溶于水,又不溶于酸。 四、 常见溶液中能反应的离子组 成水离子组 H++OH-→H2O 2H++O2-→H2O 成气离子组 2H++CO32-→H2O+CO2↑ OH-+NH4+→NH3↑+ H2O 成沉淀 离子组 成碱沉淀 Cu2++2 OH-→Cu(OH)2↓(蓝色) Fe3++3 OH-→Fe(OH)3↓(红褐色) Mg2++2OH-→Mg(OH)2↓(白色) Zn2++2 OH-→Zn(OH)2↓(白色) 成碳酸盐沉淀 Ca2++CO32-→CaCO3↓(白色) Ba2++ CO32-→BaCO3↓(白色) Zn2++ CO32-→ZnCO3↓(白色) 2Ag++ CO32-→Ag2CO3↓(白色) 成盐酸盐沉淀 Ag++Cl-→AgCl↓(白色) 成硫酸盐沉淀 Ba2++SO42-→BaSO4↓(白色) 初三化学复分解反应专题 2 五、复分解反应规律 (1 ) 成水的复分解反应 反应实质 H+ + OH- → H2O 反应规律 酸 + 碱 → 盐 + 水 化学方程式 反应现象 硫酸和氢氧化钠 盐酸和氢氧化钙 硝酸和氢氧化铜 硫酸和氢氧化铁 硫酸和氢氧化钡 反应实质 2H+ + O2- → H2O 反应规律 酸 + 金属氧化物 → 盐 + 水 化学方程式 反应现象 氧化铜和硫酸 氧化铁和硫酸 氧化铜和硝酸 氧化铁和盐...