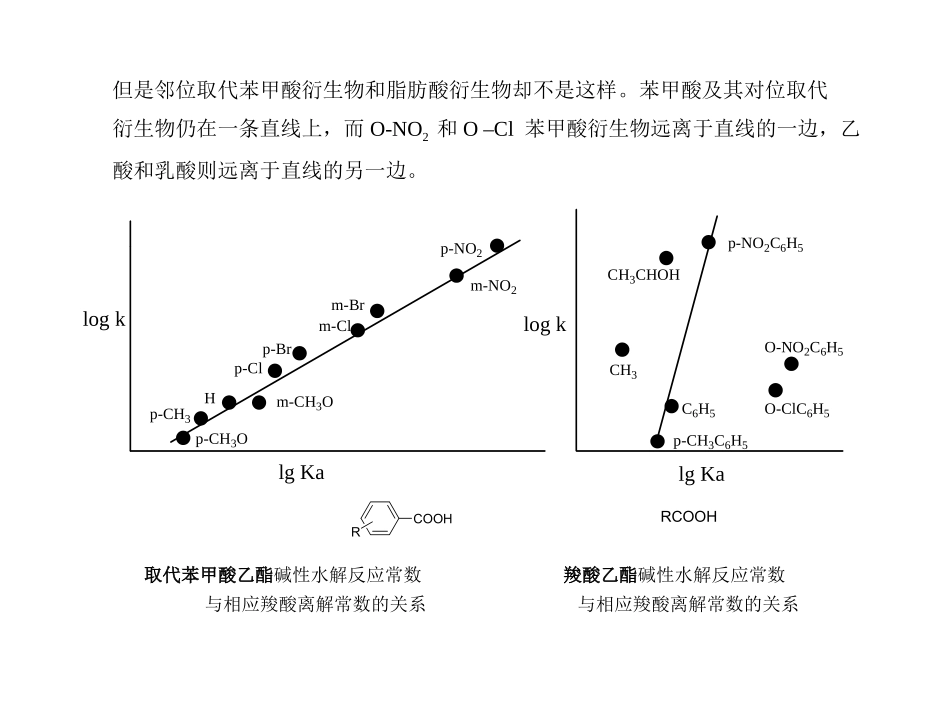
第四章分子结构与反应活性间的定量关系前面我们讨论了分子结构和化学性能之间的关系,如电子效应、溶剂效应和空间效应。但是上述讨论只限于定性。这一章节将分子结构及其反应活性联系起来,建立一方面能够解释反应机理,预测反应速度和平衡的有关关系式。在这里重点介绍哈米特方程式(hammett)。§4-1哈米特方程式一、哈米特方程式的建立37,38年L.P.Hammett分别在美国和英国化学会志上发表了一系列羧酸酯的水解反应速度常数k与相应羧酸在水中的离解常数Ka的关系。RCOOC2H5+OH-kRCOO-+C2H5OHRCOOH+H2OKaRCOO-+H3O+以lgk为纵坐标,lgKa为横坐标作图,发现间位和对位取代的苯甲酸衍生物有良好的线性关系。但是邻位取代苯甲酸衍生物和脂肪酸衍生物却不是这样。苯甲酸及其对位取代衍生物仍在一条直线上,而O-NO2和O–Cl苯甲酸衍生物远离于直线的一边,乙酸和乳酸则远离于直线的另一边。p-CH3Op-CH3m-CH3Op-Clp-Brm-Brm-Clm-NO2p-NO2HlgKalogklogklgKap-NO2C6H5p-CH3C6H5CH3CHOHCH3C6H5O-NO2C6H5O-ClC6H5取代苯甲酸乙酯碱性水解反应常数与相应羧酸离解常数的关系羧酸乙酯碱性水解反应常数与相应羧酸离解常数的关系COOHRRCOOH解释:决定化合物化学性质的因素有两种:一是电子效应;二是空间效应。有时其中一个效应占优势,有时另一种效应占优势。有时两者协同作用,有时两者起相反作用。邻位:邻位取代苯甲酸衍生物偏离直线的原因主要是空间效应。间位和对位:由于远离反应中心,不能产生空间效应,因此影响它们水解的主要因素是电子效应。哈米特经过反复的实践,推出了有名的哈米特方程。lgk=lgKa+c(y=bX+c)是一个直线方程,其中为直线的斜率,c为直线的截距,两者都是常数。进行其他化学反应时,如醇解反应,所测定的反应速度常数照同样方式作图,也得线性关系,只是斜率和截距不同。由此可见这种线性关系具有一定的普遍性。对于未取代苯甲酸酯和苯甲酸也可以写出同样的方程式。lgk0=lgKa+c0由上述两式相减,得到:lgk-lgk0=(lgKa-lgK0a)令=lgKa-lgK0a代入到上式,并整理得:lgk/k0=这就是哈米特方程式的一般形式。哈米特方程也可适用于间、对位取代苯酸的反应平衡常数K:lgK/K0=方程中的为一常数,决定于取代基的结构和苯环上的位置(间或对位),叫做取代基常数(substituentconstant)。为另一常数,是哈米特图解中直线的斜率。它取决于反应的类型及反应条件,成为反应常数(reactionconstant).那么如何确定上述两个常数和呢?哈米特指定间位和对位取代的苯甲酸在水中25oC时的离解作为标准参考反应,并且人为地规定取代苯甲酸在水中的离解反应常数=1.00,然后用测定各种取代苯甲酸的离解常数的方法,确定一系列取代基的取代基常数。由公式=lgKa-lgKa0=-lgKa0-(-lgKa)=pKa0-pKa也就是说常数是苯甲酸和相应的取代苯甲酸在水溶液中25oC时的pKa值之差。如:p-NO2=4.20-3.12=0.78m-NO2=4.20-3.49=0.71p-CH3=4.20-4.27=-0.07请看第83页的表4-1上述的取代基常数值反映某一取代基的特性,它并不依赖于反应常数,即与反应类型无关。因此,我们可以用以给出的值,按公式lgk/k0=计算出其它反应系列的反应常数。一般可采用图解法进行求解。从实验测得未取代苯衍生物的反应速度常数ko以及至少三个不同的取代苯衍生物的反应速度常数k,并知道这些基团的值,就可以lg(k/ko)为纵坐标,相应的值为横坐标作图,则得到一条直线,该直线的斜率既是这类反应的值。对于反应平衡常数K的值可用公式lgK/K0=以类似方法求得。部分反应常数值,请看第83页表4-2。二.和的意义(一)取代基常数取代基常数,也叫取代基特性常数或取代基极性因数。它表示取代基电子效应的大小,即接受电子或共给电子的大小;或者说取代基在反应中相对于氢原子的极性效应的相对度量。由公式=lgKa-lgKao,可知当>0,即为正值时Ka>Kao,该取代基使苯环电子云密度降低,表现为吸电子基;反之,<0,即为负值...