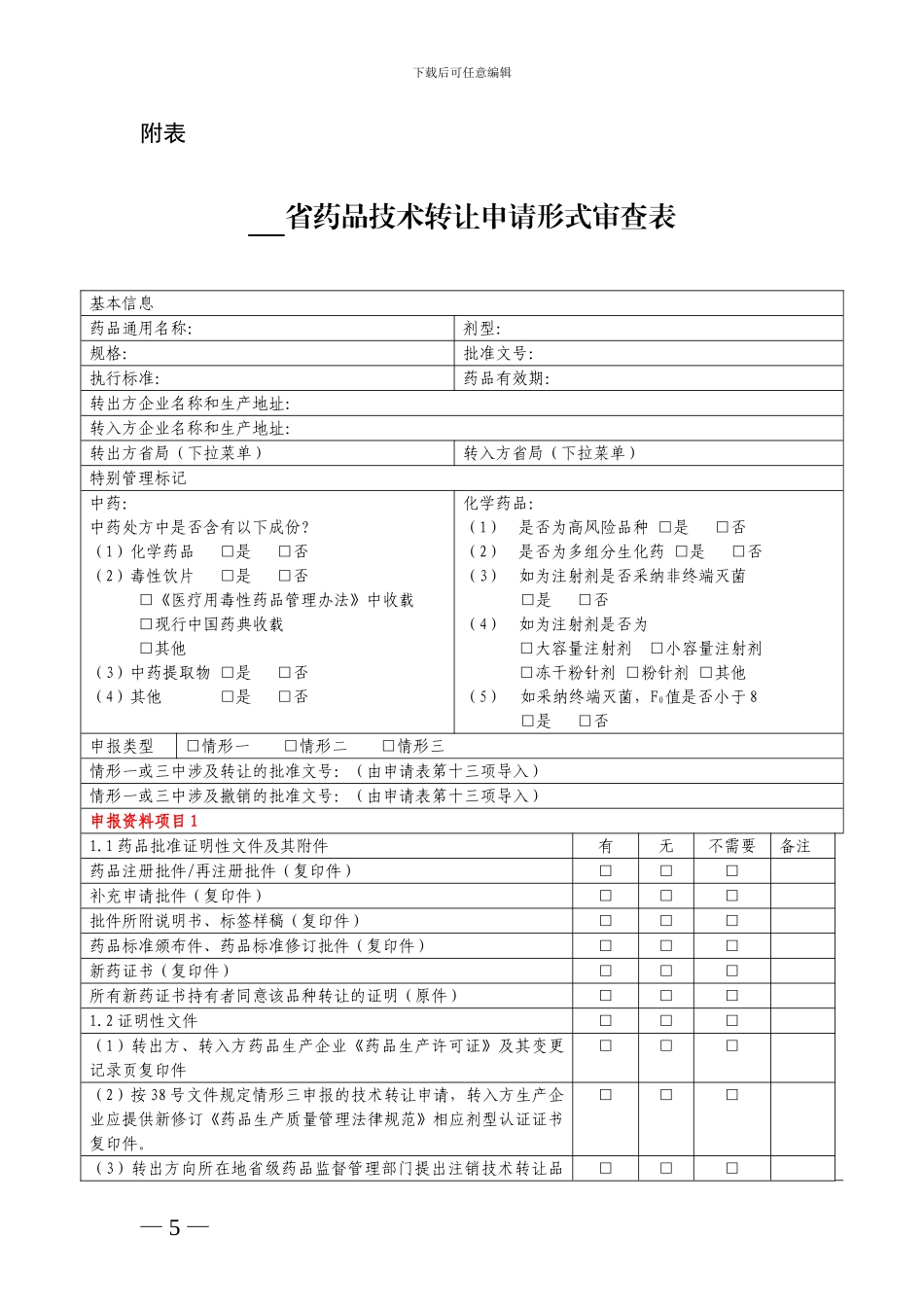
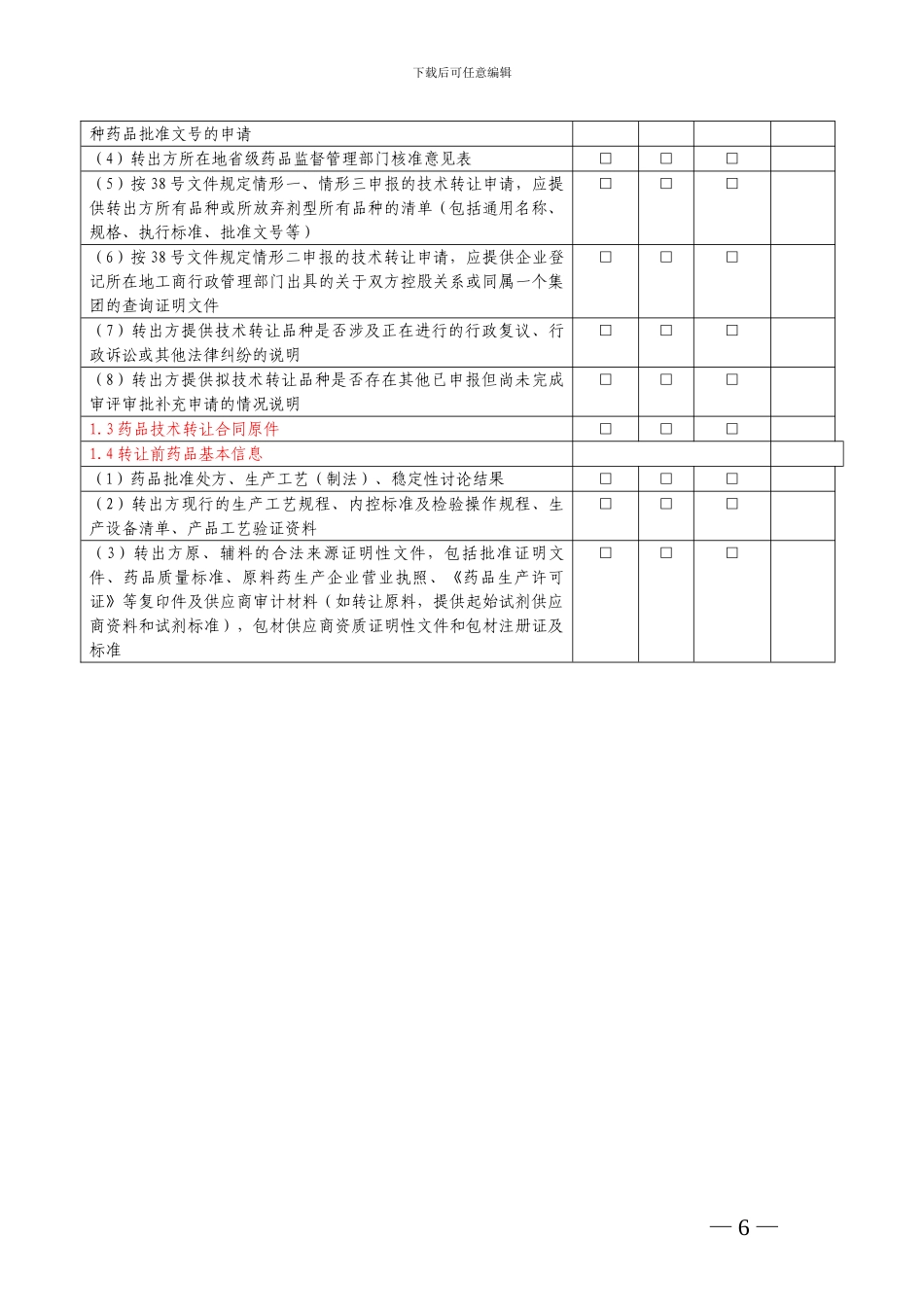
下载后可任意编辑附件 1工作流程为落实《国家食品药品监督管理局关于做好实施新修订药品生产质量管理法律规范过程中药品技术转让有关事项的通知》(国食药监注〔2024〕38 号,以下简称 38 号文件)有关要求,现将其涉及的药品技术转让注册申请事项的工作流程明确如下:申请人应根据 38 号文件要求,按药品批准文号逐一填写《药品补充申请表》,根据《申报资料项目及要求》的要求向所在地省级药品监督管理部门提交申报资料项目 1 所规定资料及相应电子文档,省级药品监督管理部门根据《申报资料项目及要求》的要求进行形式审查,符合要求的,予以签收并填写《药品技术转让申请形式审查表》(附表)。省级药品监督管理部门根据《审查审评要点》的要求对申报资料进行审查,必要时可要求申请人补充资料,并说明理由,审核符合要求的,发给《受理通知书》,不符合要求的,发给不予受理通知书。药品技术转让补充申请受理后,申请人完成相应技术讨论工作,凭《受理通知书》,提出开展后续技术审评工作申请,根据《申报资料项目及要求》的要求向所在地省级药品监督管理部门提交申报资料项目 2、项目 3 等资料及相应电子文档。省级药品监督管理部门根据《申报资料项目及要求》的要求进行审查,符合要求的,予以签收。省级药品监督管理部门根据相关要求组织开展技术审评、生产现场检查,并进行抽样检验。必要时可要求申请人补充资料,并说明理由。省级药品监督管理部门依据技术审评意见、生产现场检查报告和样品检验结果形成综合审评意见,依据综合意见起草《补充申请批件》/《审批意见通知件》送签件,将药品补充申请表、省局核准意见表、药品技术转让申请形式审查表、受理通知书、技术审评意见、生产现场检查报告、样品检验结果、综合审评意见和送签件电子文档上传总局信息系统,并同时将送签件纸质文件上报国家食品药品监督管理总局,审评符合要求的,发给《补充申请批件》,核发药品批准文号,同时注销原药品批准文号,审评不符合要求的,发给《审批意见通知件》。附表: 省药品技术转让申请形式审查表— 4 — 下载后可任意编辑附表 省药品技术转让申请形式审查表基本信息药品通用名称:剂型:规格:批准文号:执行标准:药品有效期:转出方企业名称和生产地址:转入方企业名称和生产地址:转出方省局(下拉菜单)转入方省局(下拉菜单)特别管理标记中药:中药处方中是否含有以下成份?(1)化学药品 □是 □否(2)毒性饮片 □是 □...