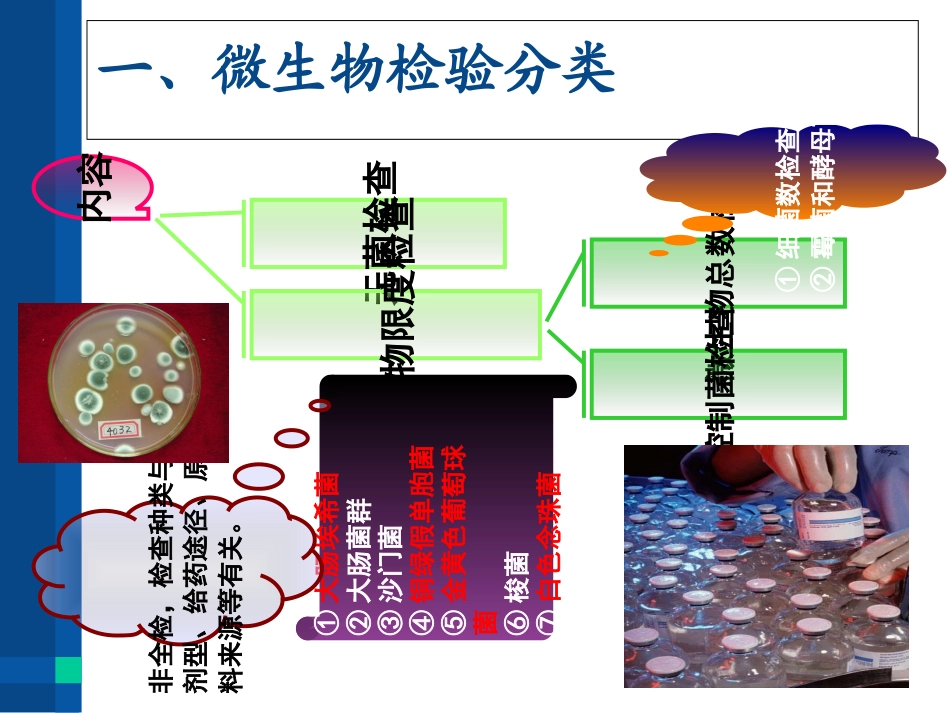
药物制剂微生物检验目录1、微生物检验分类2、药品微生物限度检测的基本条件3、非灭菌制剂的微生物限度检查4、灭菌制剂的无菌检查法一、微生物检验分类内容无菌检查微生物限度检查微生物总数检查控制菌检查①细菌数检查②霉菌和酵母菌检查①大肠埃希菌②大肠菌群③沙门菌④铜绿假单胞菌⑤金黄色葡萄球菌⑥梭菌⑦白色念珠菌非全检,检查种类与剂型、给药途径、原料来源等有关。无菌检查凡直接进入人体血液循环系统、肌肉、皮下组织或接触创伤、溃疡部位而发生作用的制品或要求无菌的材料、灭菌器具都要进行无菌检查。•注射用制剂:注射剂、输液、注射粉针等;•眼用制剂:滴眼剂、眼用膜剂、凝胶剂、软膏剂等;•植入型制剂:植入片等;•创面用制剂:溃疡、烧伤及外伤用溶剂、软膏剂及气雾剂等•手术用制剂、止血海绵、骨蜡等二、药品微生物限度检测的基本条件二、药品微生物限度检测的基本条件检查环境和人员要求环境要求:无菌室内进行。背景洁净度C级下的局部A级(洁净操作台),单向流空气。操作人员:卫生、着装符合要求。操作要求:严格遵守无菌操作,严防污染。二、药品微生物限度检测的基本条件方法㈡由于某些供试品具有抗菌活性,在建立测定方法或原测定法的检验条件发生改变时,可能影响检验结果的准确性,必须对供试品的抑菌活性及测定方法的可靠性进行验证。二、药品微生物限度检测的基本条件取样量㈢1.检测用量①所有剂型>2个最小包装②大蜜丸≥4丸③膜剂≥4片2.检测量①半/固体制剂:10g②液体制剂:10ml③膜剂:100cm二、药品微生物限度检测的基本条件培养条件㈣二、药品微生物限度检测的基本条件供试品检出控制菌或其它致病菌时,按一次检出结果为准,不再复试。供试品的细菌数、霉菌和酵母菌数其中任何一项不符合该品种项下的规定,应从同一批样品中随机抽样,独立复试两次,以3次结果的平均值报告菌数。供试品的细菌数、霉菌和酵母数及控制菌三项检验结果均符合该品种项下的规定,判供试品符合规定;若其中任何一项不符合该品种项下的规定,判供试品不符合规定。结果判断㈤第三节药品微生物限度检测方法微生物检验基本流程1、领取并配制培养基2、擦拭工作台及墙壁3、开启紫外灯灭菌1h4、进行微生物实验5、实验完成后再次擦拭工作台二、细菌数、霉菌和酵母菌数检查1、平皿法数据处理混合平板的制备细菌、真菌的培养检查结果、观察与计数供试液的制备书写检验记录单二、细菌数、霉菌和酵母菌数检查1.平皿法10-210-210-210-210-310-310-310-3倒置培养3d营养琼脂培养基30~35℃玫瑰红钠琼脂培养基倒置培养5d23~28℃对照对照对照对照1.0ml9.0ml稀释液10g/ml供试品9.0ml10-210-11.0ml9.0ml10-31.0ml10-110-110-110-110倍递增稀释法二、细菌数、霉菌和酵母菌数检查10g或10ml供试品10-1供试液取相当于1g或1ml供试液用滤膜过滤、冲洗取下滤膜,菌面朝上放培养基上培养结果观察与计数数据处理书写检验记录单2.薄膜过滤法封闭式薄膜过滤器传统开放式薄膜过滤器二、细菌数、霉菌和酵母菌数检查3.操作注意事项1.尽量使菌细胞分散开,使每个菌细胞生成一个菌落,否则将会导致重大的技术误差。2.为防止细菌增殖及产生菌苔,制成供试液后,应尽快稀释,注皿。一般稀释后应在1小时内操作完毕。二、细菌数、霉菌和酵母菌数检查3.操作注意事项3.使用吸量管时,应小心沿管壁加入,不用触及管内溶液,以防吸管尖端外侧黏附的溶液混入其中。4.注意抑菌现象。由于防腐剂未被中和,往往使平板计数结果受影响,如低稀释时菌落少。而高释释度时菌落数反而增大。遇此情况应重复检验,以确定是防腐剂影响还是操作技术误差。二、细菌数、霉菌和酵母菌数检查3.操作注意事项5.为检查和控制灭菌效果,应做空白对照,以检验所使用的物品是否彻底灭菌及检验过程是否无菌操作。6.为便于区别药品中的颗粒与菌落,可在每100mL营养琼脂中加入1mL0.5%的TTC溶液,如有细菌存在,培养后菌落呈红色,而药品的颗粒颜色无变化。二、细菌数、霉菌和酵母菌数检查4.菌落计数及报告方法宜选取细菌、酵母菌平均菌落数在30-300之间、霉菌平均菌落数小于100cfu的稀释级,作为菌数报告(取两位...