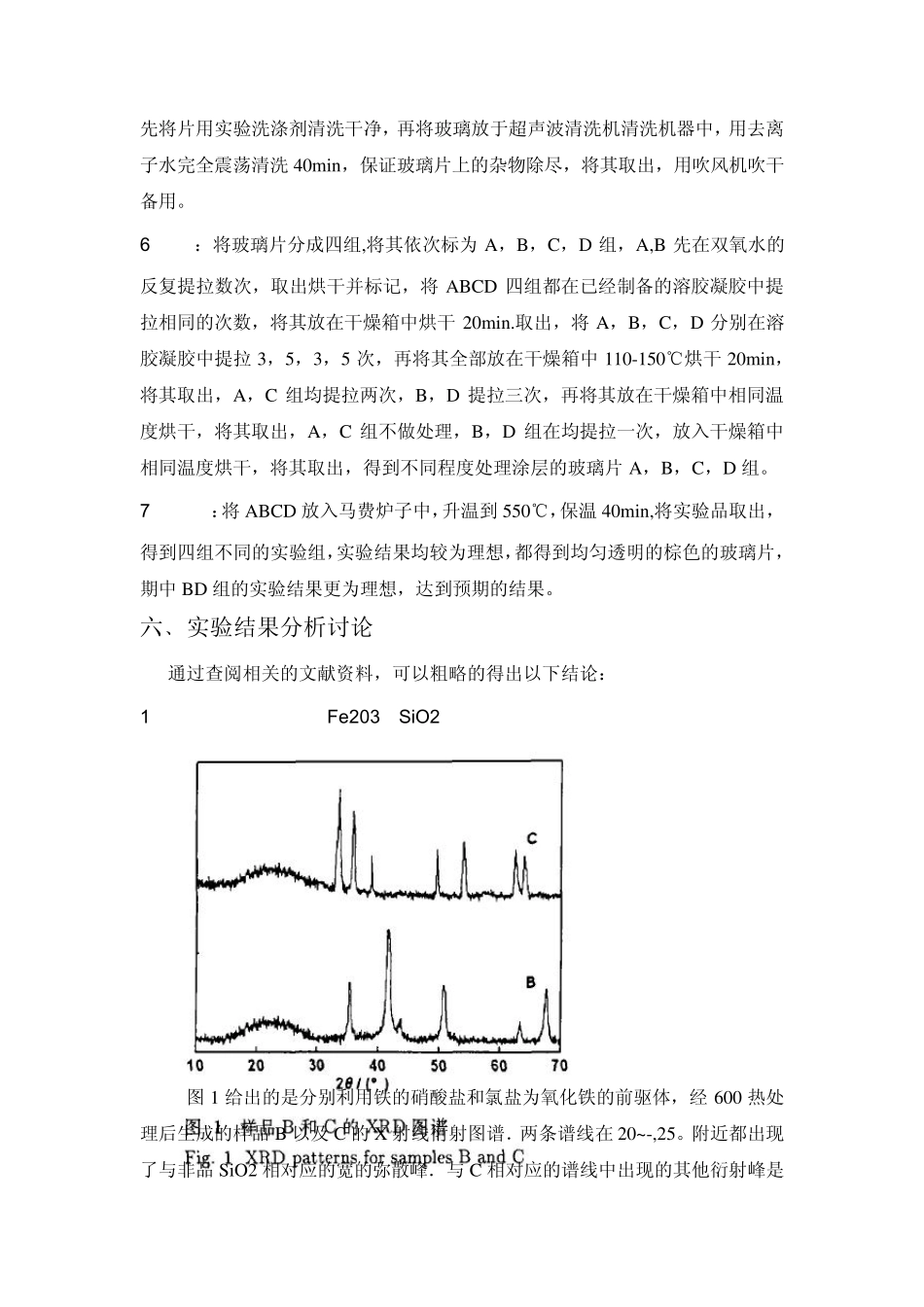
溶胶-凝胶法制备 Fe2O3/SiO2 薄膜 一﹑实验目的 1.溶胶凝胶的原理 2.溶胶-凝胶法合成薄膜 Fe2O3/SiO2 3.复习及综合应用无机化学的反应理论,物理化学的胶体理论 4.通过实验,进一步加深对基础理论的理解和掌握,做到有目的合成,提高实验思维与实验技能 二﹑实验简介 溶胶是指微小的固体颗粒悬浮分散在液相中,并且不停的进行布朗运动的体系。根据粒子与溶剂间相互作用的强弱,通常将溶胶分为亲液型和憎液型两类。由于界面原子的 Gibbs自由能比内部原子高,溶胶是热力学不稳定体系。凝胶是指胶体颗粒或高聚物分子互相交联,形成空间网状结构,在网状结构的孔隙中充满了液体(在干凝胶中的分散介质也可以是气体)的分散体系。并非所有的溶胶都能转变为凝胶,凝胶能否形成的关键在于胶粒间的相互作用力是否足够强,以致克服胶粒-溶剂间的相互作用力。对于热力学不稳定的溶胶,增加体系中粒子间结合所须克服的能垒可使之在动力学上稳定。因此,胶粒间相互靠近或吸附聚合时,可降低体系的能量,并趋于稳定,进而形成凝胶。 三﹑实验原理 溶胶-凝胶法(Sol-Gel法)是指无机物或金属醇盐经过溶液、溶胶、凝胶而固化,再经热处理而成的氧化物或其它化合物固体的方法。 具体以硝酸铁和正硅酸乙酯分别作为氧化铁和 SiO2 的前驱体,通过溶胶一凝胶工艺制备了Fe2O3/SiO2 纳米复合粉体.若使用氯化铁为氧化铁前驱体,SiO2基体中则会生成 Fe2O3.当干凝胶热处理温度较低时(T<400℃),复合粉体(硝酸铁为前驱体)以非晶态存在.当 达到 600℃时, Fe2O3 粒子在 SiO2 基体中大量形成随着热处理温度的进一步升高,粉体中开始有 Fe2O3 杂质生成。 四﹑实验仪器试剂 仪器:量筒,烧杯,锥形瓶,容量瓶,滴管,电磁搅拌器,恒温干燥厢,高温炉; 试剂:硝酸铁和正硅酸乙酯,无水乙醇,盐酸,蒸馏水,双氧水等。 五﹑实验内容与过程: Fe2O3 的制备: 所用试剂主要包括正硅酸乙酯、无水乙醇、Fe(NO3)3·9H20 和FeC13·6H20,皆为分析纯. 1 计量:将 86mL 正硅酸乙酯溶于 153mL 无水乙醇中制得溶液 X,将29gFe(NO3)3·9H2O 溶于 61mL 蒸馏水中得到红棕色透亮溶液 Y。 2 混合:室温下量取红棕色透亮溶液 Y,缓慢滴入到溶液 X 中,用磁力搅拌器强力搅拌10min,混合均匀,形成棕褐色澄清溶液 A。继续将冰醋酸和蒸馏水加到另 300mL 无水乙醇中,剧烈搅拌,得到溶液 B,滴入 1-2 滴盐酸,调节 pH值使 pH≤3。 3...