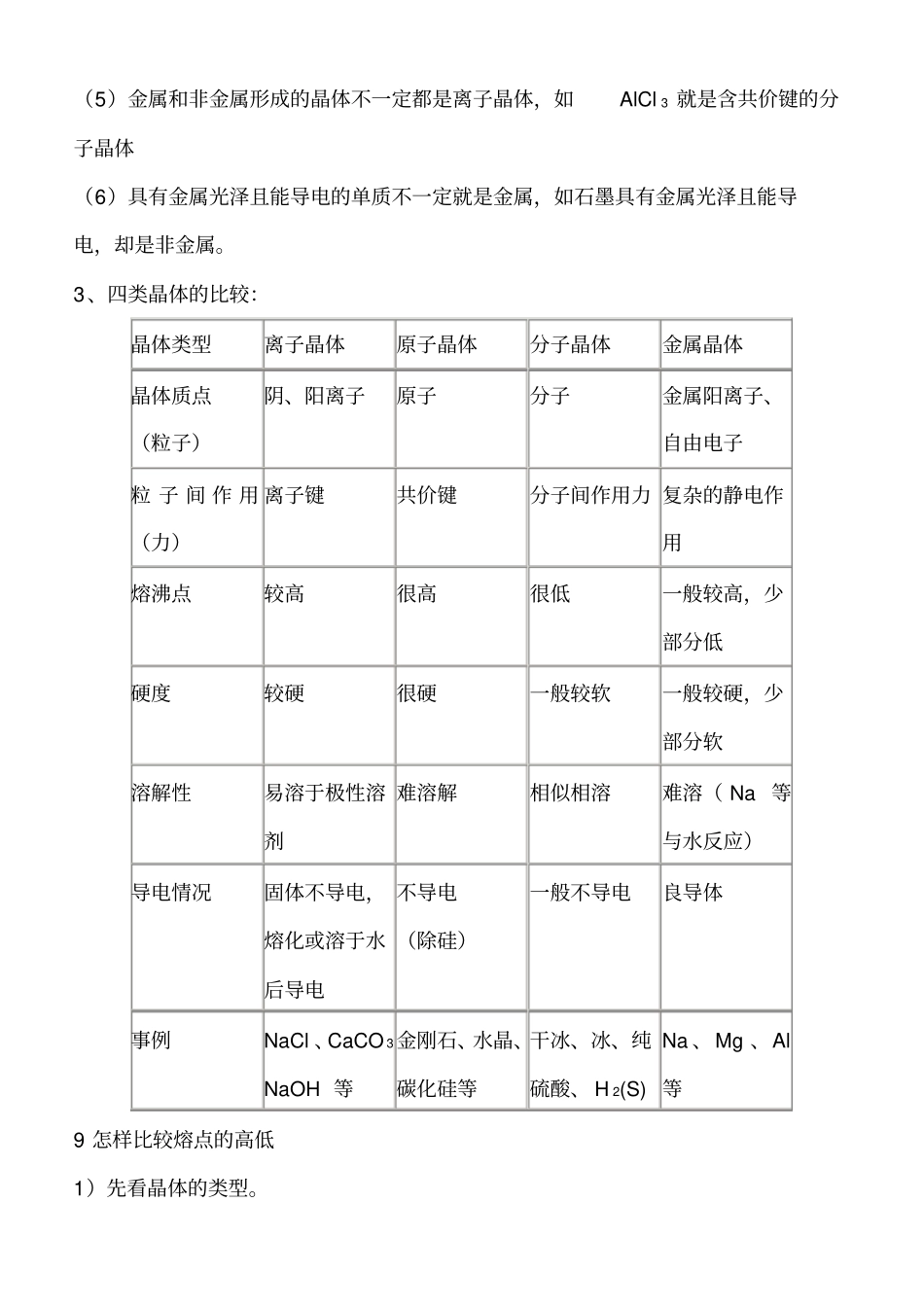
晶体类型的判断与比较,晶体结构的计算,怎样比较熔点的高低,8 晶体类型的判断与比较1、判断晶体类型的方法(1)依据物质的分类判断金属氧化物(如K2O、Na 2O2 等),强碱(如 NaCl 、KOH 等)和绝大多数的盐类是离子晶体。 大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO 2 外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体单质有金刚石、石墨、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金都是金属晶体。(2)依据物质的性质判断离子晶体的熔点较高,常在数百至1000 余度;原子晶体熔点高,常在1000 度至几千度;分子晶体熔点低,常在数百度以下至很低温度;金属晶体多数熔点高,但也有相当低的。离子晶体水溶液及熔化时能导电,晶体不导电;原子晶体一般为非导体,但石墨等导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子也能导电,但熔化不导电,金属晶体是良导体。2、晶体中的几个不一定(1)离子晶体除含离子键外不一定不含其他化学键。如氨盐中除含离子键,还含极性键和配位键; Na 2O2 中除含离子键还含非极性键。(2)离子晶体不一定肯定含金属阳离子,如 NH 4Cl 中含的阳离子是 NH 4+ (凡是氨盐、肯定同时含离子键、极性键和配位键)。(3)离子晶体的熔点不一定肯定低于原子晶体,如 MgO 的熔点高于 SiO 2。(4)含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。(5)金属和非金属形成的晶体不一定都是离子晶体,如AlCl 3 就是含共价键的分子晶体(6)具有金属光泽且能导电的单质不一定就是金属,如石墨具有金属光泽且能导电,却是非金属。3、四类晶体的比较:晶体类型离子晶体原子晶体分子晶体金属晶体晶体质点(粒子)阴、阳离子原子分子金属阳离子、自由电子粒 子 间 作 用(力)离子键共价键分子间作用力 复杂的静电作用熔沸点较高很高很低一般较高,少部分低硬度较硬很硬一般较软一般较硬,少部分软溶解性易溶于极性溶剂难溶解相似相溶难溶( Na 等与水反应)导电情况固体不导电,熔化或溶于水后导电不导电(除硅)一般不导电良导体事例NaCl 、CaCO 3NaOH 等金刚石、水晶、碳化硅等干冰、冰、纯硫酸、 H 2(S) Na 、Mg 、Al等9 怎样比较熔点的高低1)先看晶体的类型。不同晶体类型的物...