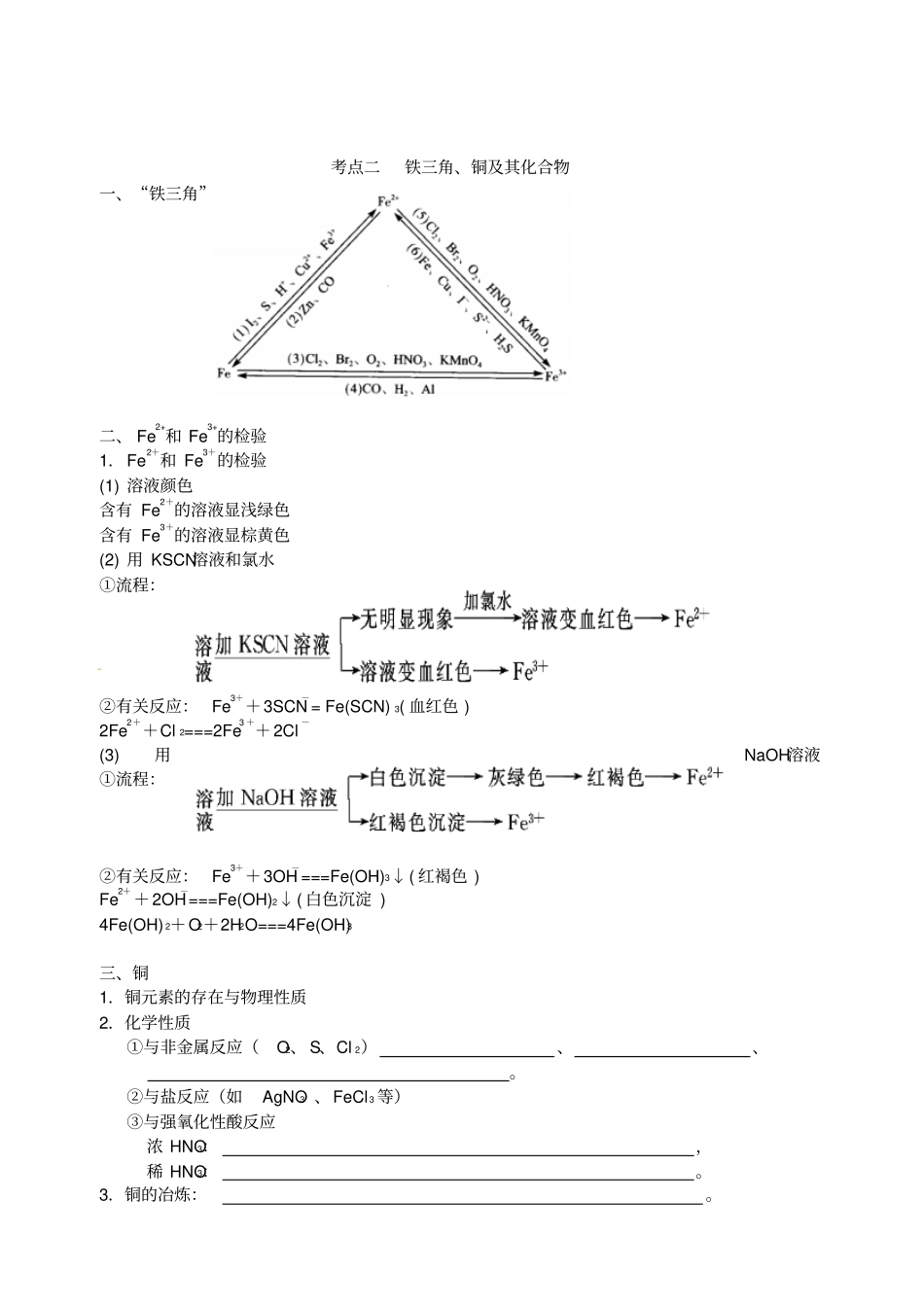
铁、铜及其化合物〖复习目标〗1.了解铁、铜及其重要化合物的主要性质和重要应用。2.了解铁、铜的不同类型化合物之间转化的条件和方法,认识化学在金属矿物等自然资源综合利用方面的重要作用。〖知识清单〗考点一铁及其化合物一、铁1.物理性质2.化学性质⑴与非金属反应(O2、Cl 2、S) ⑵与水蒸气反应的化学方程式为:。⑶与酸反应①与非氧化性酸如与稀 H2 SO4、盐酸等反应,其离子方程式为:。②与氧化性酸如与稀 HNO3反应,一般不产生H2,常温下,可被、钝化。a.稀 HNO3过量时生成Fe3+,其离子方程式:b.铁过量时生成Fe2+,其离子方程式:⑷与盐溶液反应①能与活动性较弱的金属盐溶液反应,如Fe 和 CuSO4溶液反应的离子方程式为:。②与 FeCl 3 溶液反应,其离子方程式为:。二、铁的氧化物和氢氧化物1.铁的氧化物氧化亚铁氧化铁四氧化三铁色态化学式与酸反应产生的离子HCl HNO32.铁的氢氧化物氢氧化物氢氧化亚铁氢氧化铁化学式2颜色化学性质O2HCl 加热制法〖典型例析〗例 1、取 100mL 0.2mol/L FeCl3 溶液置于烧杯中,向其中加入一定量的Fe、Cu 混合物,充分反应后仍有固体剩余,下列叙述一定正确的是(设溶液体积不变,不考虑水解因素)A.若烧杯中有Fe 无 Cu, c(Fe2+)=0.2 mol · L-1B.若烧杯中有Cu无 Fe, c(Fe2+)=0.3 mol · L-1C.若烧杯中有Cu无 Fe, c(C1-)=0.6 mol · L-1D.若烧杯中Cu、 Fe 均有, c(Fe2+)=0.3 mol · L-1互动探究:在符合C、D两项要求的溶液中,金属阳离子的存在情况如何?例 2、某学生拟用含有FeSO4和 Fe2(SO4) 3的 CuSO4溶液提纯CuSO4,并测定铜的相对原子质量,其实验流程如下图所示:已知氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pH Fe3+1.9 3.2 Fe2+7.0 9.0 Cu2+4.7 6.7 供选择的试剂有:Cl 2、H2O2、浓 H2SO4、NaOH溶液、 CuO、Cu 试回答下列问题:⑴试剂 A 的化学式为,加入试剂A 反应的离子方程式为,试剂 B的化学式为,加入 B 的作用是,操作①的名称是。⑵操作②中所用仪器装置如图所示:则 X 应接直流电源的极,Y 电极上发生的电极反应式为:。酸化的CuSO4 溶液含有少量 FeSO4 和Fe2(SO4)3,pH=1.7试剂 A 溶液 M 试剂 B 操作①沉淀物溶液 N 操作②某电极增重a g 另一电极上产生标准状况下的气体 VmL 考点二铁三角、铜及其化合物一、“铁三角”二、 Fe2+和 Fe3+的检验1.Fe2+和 Fe3+的检验(1) 溶...