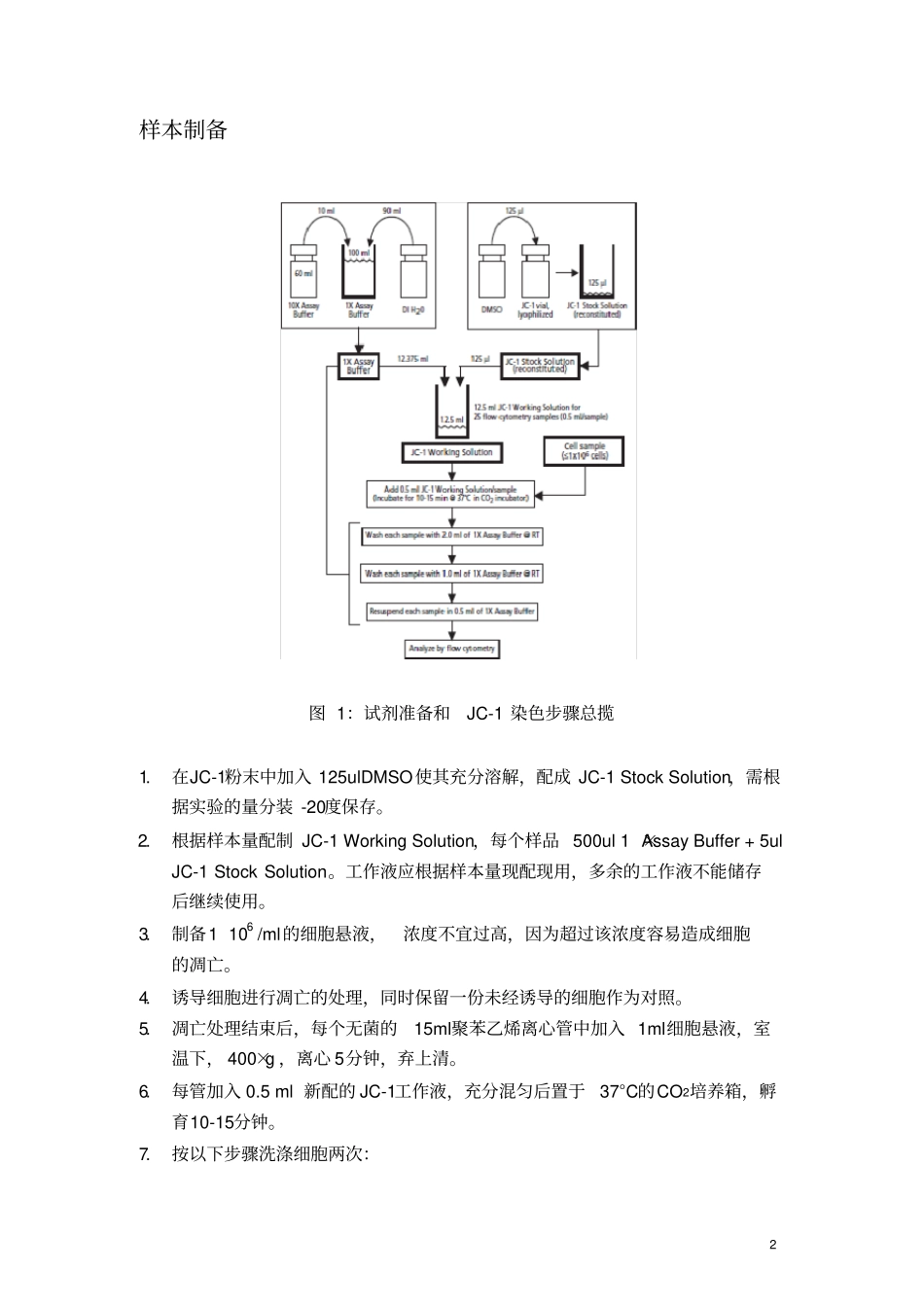
1 线粒体膜电位变化 检测细胞凋亡实验原理JC-1(5,5 ′,6,6 ′-Tetrachloro-1,1 ′,3,3 ′-tetraethyl-imidacarbocyanine iodide)是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential)△Ψ m 的理想荧光探针。可以检测细胞、组织或纯化的线粒体膜电位。在线粒体膜电位较高时,JC-1 聚集在线粒体的基质 (matrix)中,形成聚合物 (J-aggregates),可以产生红色荧光(FL-2 通道);在线粒体膜电位较低时,JC-1 不能聚集在线粒体的基质中,此时 JC-1 为单体 (monomer),可以产生绿色荧光( FL-1 通道)。这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。常用红绿荧光的相对比例来衡量线粒体去极化的比例。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。通过JC-1 从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1 从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。JC-1 单体的最大激发波长为514nm,最大发射波长为527nm;JC-1 聚合物(J-aggregates)的最大激发波长为585nm,最大发射波长为590nm。实验用品1. 12 75mm 的 Falcon 管和 15ml 聚苯乙烯离心管2.微量加样器和加样头3.线粒体检测试剂盒(货号 551302,100tests),包括 JC-1和10 Assay Buffer, 注:每个KIT 包括 4 小瓶 JC-1 试剂,每小瓶试剂足够检测25 个样本4.离心机5.CO2 培养箱6.流式细胞仪2 样本制备图 1:试剂准备和JC-1 染色步骤总揽1.在JC-1粉末中加入 125ulDMSO使其充分溶解,配成 JC-1 Stock Solution,需根据实验的量分装 -20度保存。2.根据样本量配制 JC-1 Working Solution,每个样品 500ul 1 ×Assay Buffer + 5ul JC-1 Stock Solution。工作液应根据样本量现配现用,多余的工作液不能储存后继续使用。3.制备1 106 /ml的细胞悬液,浓度不宜过高,因为超过该浓度容易造成细胞的凋亡。4.诱导细胞进行凋亡的处理,同时保留一份未经诱导的细胞作为对照。5.凋亡处理结束后,每个无菌的15ml聚苯乙烯离心管中加入 1ml细胞悬液,室温下, 400×g ,离心 5分钟,弃上清。6.每管加入 0.5 ml 新配的 JC-1工作液,充分混匀后置于37°C的CO2培养箱,孵育10-15分钟。7.按以下步骤洗涤细胞两次: