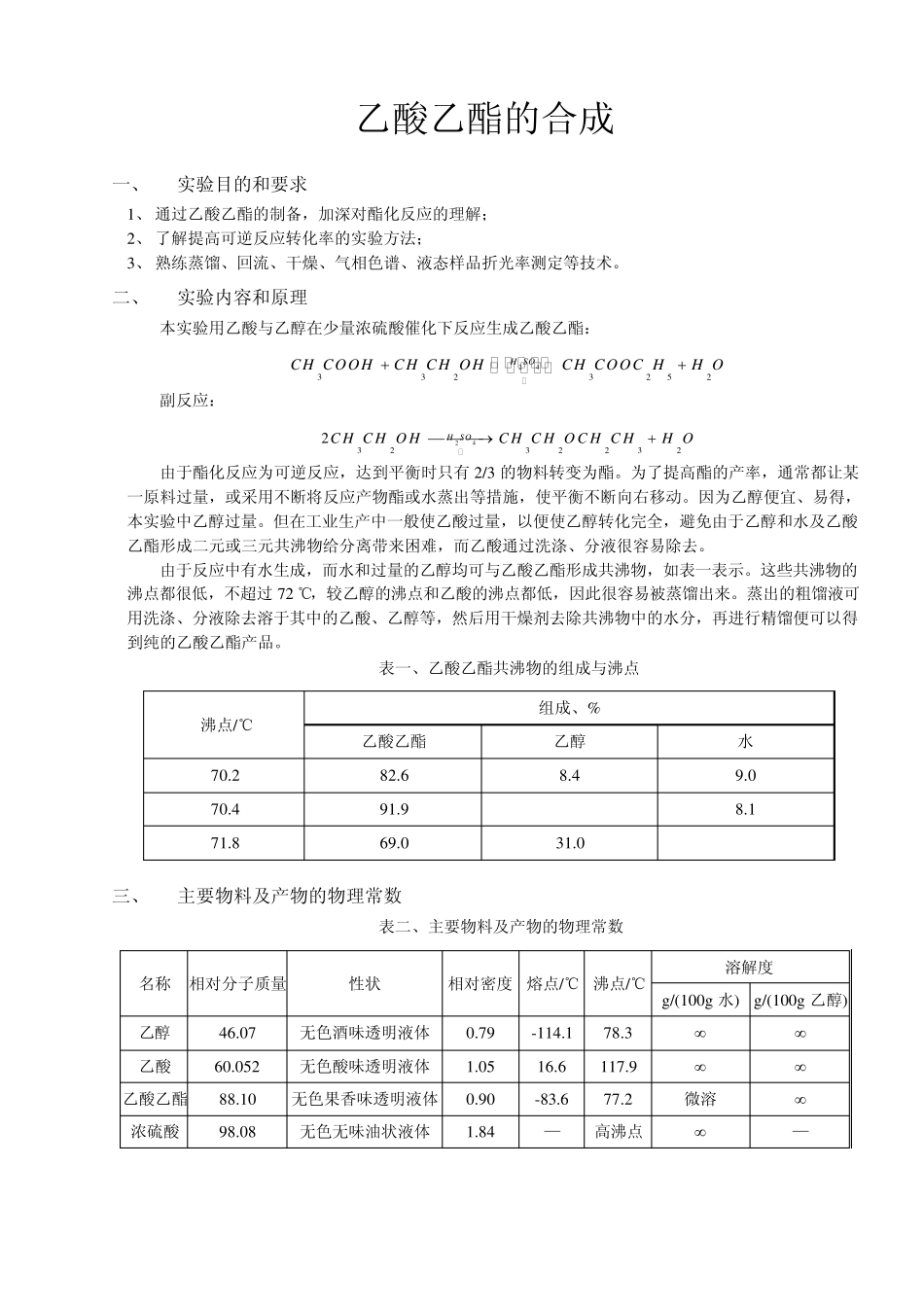
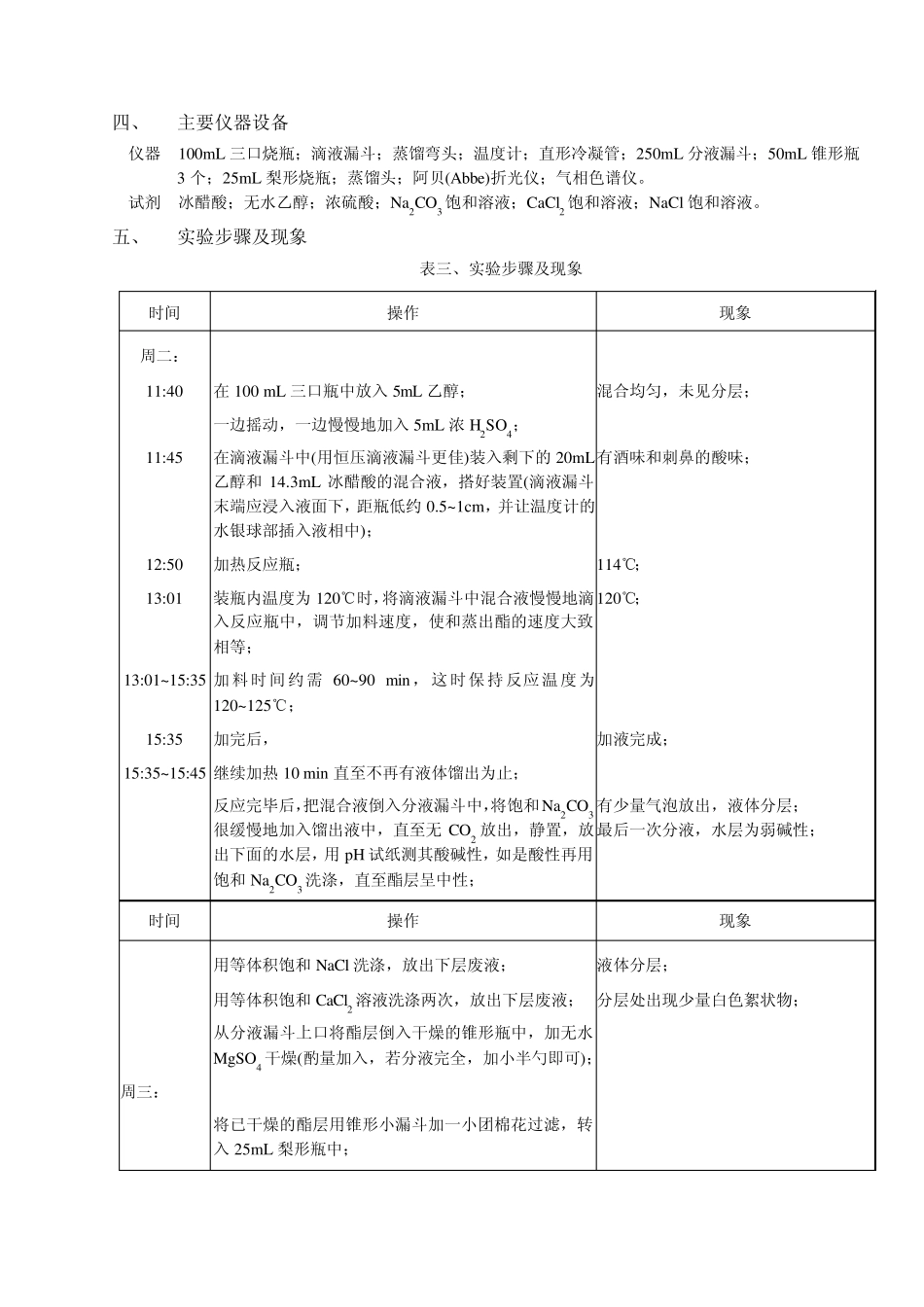
乙酸乙酯的合成 一、 实验目的和要求 1 、 通过乙酸乙酯的制备,加深对酯化反应的理解; 2 、 了解提高可逆反应转化率的实验方法; 3 、 熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。 二、 实验内容和原理 本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯: 243323252H SOCH COOHCH CH OHCH COOC HH O 副反应: 2432322322H SOC H C H O HC H C H O C H C HH O 由于酯化反应为可逆反应,达到平衡时只有 2 /3 的物料转变为酯。为了提高酯的产率,通常都让某一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。因为乙醇便宜、易得,本实验中乙醇过量。但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。 由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。这些共沸物的沸点都很低,不超过 7 2 ℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。 表一、乙酸乙酯共沸物的组成与沸点 沸点/℃ 组成、% 乙酸乙酯 乙醇 水 7 0 .2 8 2 .6 8 .4 9 .0 7 0 .4 9 1 .9 8 .1 7 1 .8 6 9 .0 3 1 .0 三、 主要物料及产物的物理常数 表二、主要物料及产物的物理常数 名称 相对分子质量 性状 相对密度 熔点/℃ 沸点/℃ 溶解度 g /(1 0 0 g 水) g /(1 0 0 g 乙醇) 乙醇 4 6 .0 7 无色酒味透明液体 0 .7 9 -1 1 4 .1 7 8 .3 ∞ ∞ 乙酸 6 0 .0 5 2 无色酸味透明液体 1 .0 5 1 6 .6 1 1 7 .9 ∞ ∞ 乙酸乙酯 8 8 .1 0 无色果香味透明液体 0 .9 0 -8 3 .6 7 7 .2 微溶 ∞ 浓硫酸 9 8 .0 8 无色无味油状液体 1 .8 4 — 高沸点 ∞ — 四、 主要仪器设备 仪器 100mL 三口烧瓶;滴液漏斗;蒸馏弯头;温度计;直形冷凝管;250mL 分液漏斗;50mL 锥形瓶3 个;25mL 梨形烧瓶;蒸馏头;阿贝(Abbe)折光仪;气相色谱仪。 试剂 冰醋酸;无水乙醇;浓硫酸;Na2CO3 饱和溶液;CaCl2 饱和溶液;NaCl 饱和溶液...