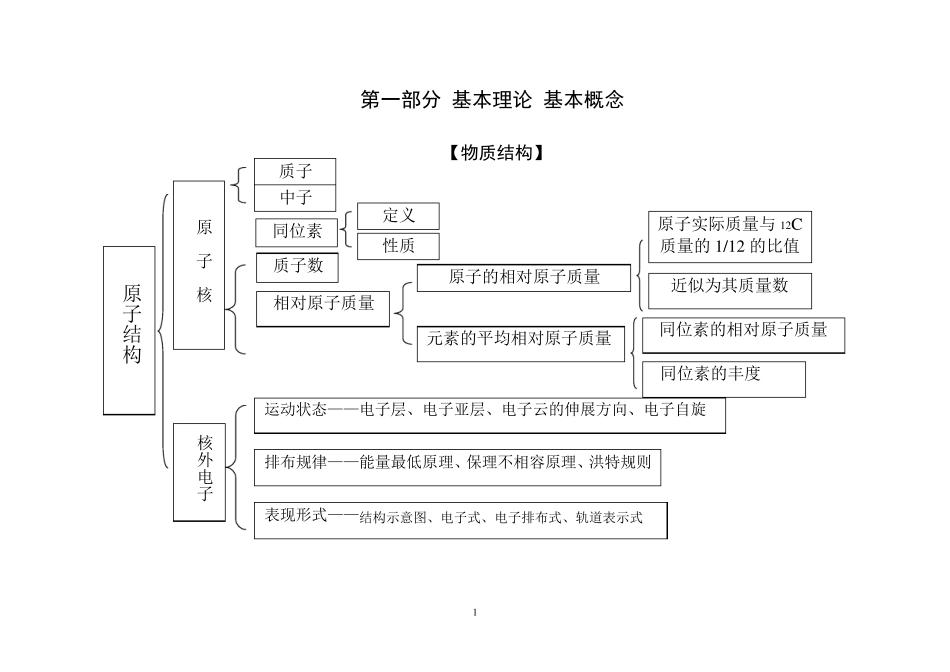
1 第一部分 基本理论 基本概念 【物质结构】 质子 中子 同位素 质子数 定义 性质 相对原子质量 原子实际质量与12C质量的1/12 的比值 元素的平均相对原子质量 近似为其质量数 运动状态——电子层、电子亚层、电子云的伸展方向、电子自旋 排布规律——能量最低原理、保理不相容原理、洪特规则 表现形式——结构示意图、电子式、电子排布式、轨道表示式 原子结构 原 子 核 核外电子 原子的相对原子质量 同位素的相对原子质量 同位素的丰度 2 单质分子 化 合 物 分 子 极性分子:空间结构不对称 非极性分子:分子空间结构对称 分子结构 单原子分子 多原子分子 双原子分子 共价分子 结合力:共价键 表示形式 结构式 电子式 3 定义 类型 化学键 离子键 共价键 金属键 定义 类型 参数 定义 形成条件:活泼金属与活泼非金属 化合物类型 强弱 极性共价键:成键原子不同 非极性共价键:成键原子相同 键能:键能越大,键越稳定 键长:键长越短,键越稳定 键角:决定原子的空间排列,可判断分子的极性与非极性 活泼金属氧化物 强 碱 大多数盐 电荷多少 离子间距离 存在:共价分子中、原子晶体里;离子晶体中可能含有共价键 4 晶体结构 类型 微粒 作用力 代表物 熔沸点 硬度 分子晶体 分子 范德华力 干冰 低 小 离子晶体 阴、阳离子 离子键 NaCl 较高 较大 原子晶体 原子 共价键 金刚石 高 大 金属晶体 金属离子和自由电子 金属键 Fe、Na 晶体熔沸点比较表 晶体类型 原子晶体>离子晶体>分子晶体(有特例) 分子晶体 式量越大,熔沸点越高,还与氢键、对称性、不饱和度有关 离子晶体 电荷和离子间距离 原子晶体 键能→键长→原子半径→周期中位置 5 电子排布的周期性 元素周期律 元素周期表 长周期 不完全周期 周期 族 主族 副族 零族 第Ⅷ族 周期表的结构 递变规律 结构 位置 性质 主要化合价 原子半径 金属性、非金属性 应用 预测元素性质 农药、半导体、合金、催化剂、光电管 金属性强弱判断依据 非金属性强弱判断依据 短周期 【元素周期律】 6 【化学反应速率与化学平衡】概念 化学反应速率 表示方法 特点 影响因素 v = c t 速率为平均速率,均为正值 速率比为系数比 一个化学反应以不同物质表示的速率,其数值可能不同,但含义一样 内因 外因 反应物本身 温度影响 浓度影响 压强影响 催化...